In den Industrieländern gehören Adipositas und Diabetes mit zu den größten gesundheitlichen Problemen dieses Jahrhunderts. Tatsächlich hat sich die Adipositas-Rate in den letzten 50 Jahren weltweit fast verdreifacht.1 Sie betrifft, ohne jeden Unterschied im sozialen und wirtschaftlichen Status, alle Bevölkerungsgruppen (Kinder, Erwachsene, ältere Menschen). Adipositas stellt einen wesentlichen Risikofaktor für schwere ernährungsbedingte, nicht übertragbare Krankheiten, einschließlich Typ-2-Diabetes dar. Appetit und Einlagerung von Körperfett werden u.a. durch ein Peptidhormon namens Ghrelin positiv reguliert.2 Somit ist Ghrelin für die Behandlung von Adipositas ein wichtiges endokrinologisches Ziel.
Die Funktion von Ghrelin
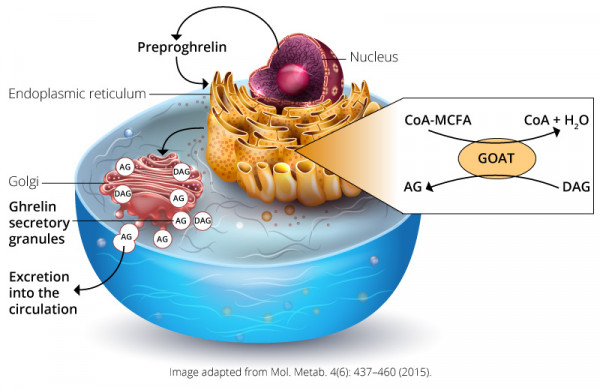
Ghrelin wurde 1999 von Masayasu Kojima, Kenji Kangawa und deren Kollegen entdeckt. Es ist ein 28 Aminosäuren langes Hormon, das durch das Präproghrelin-Gen GHRL in enteroendokrinen Zellen des Magen-Darm-Trakts exprimiert wird. Es stimuliert die Freisetzung des Growth Hormone (GH) durch Bindung des Growth Hormone-Sekretagog-Rezeptors (GHSR) 1a in der Hypophysenvorderwand.3 GHSR1a wird auch in den Pankreasinseln, den Nebennieren, dem Myokard, der Schilddrüse, dem Hypothalamus, dem Hippocampus und dem Mittelhirn exprimiert.4 Im Hypothalamus findet sich GHSR1a im Nucleus arcuatus (ARC) und ist auch in Neuronen co-lokalisiert, die das Neuropeptid Y (Npy) und das Agouti-verwandte Peptid (Agrp) exprimieren. Diese Peptide sind mit der Nahrungsaufnahme und Sättigungsregulation assoziiert.5 Für die Aktivierung von GHSR muss Ghrelin durch eine Fettsäureseitenkette am Serin an Position 3 acyliert werden. Diese posttranslationale Modifikation wird durch die Ghrelin-O-Acyl-Transferase (GOAT) ermöglicht. Diese Modifikation, hauptsächlich Oktanoylierung und/oder Decanoylierung, ist für die Wirkung von Ghrelin auf den Metabolismus obligatorisch. Interessanterweise stammen die Substrate (Lipide) für die Ghrelin-Acylierung, die durch GOAT vermittelt wird, fast ausschließlich aus den Fetten, die durch Nahrungszufuhr aufgenommen wurden. Diese kurz- bis mittelkettigen Fettsäuren müssen mit dem Coenzym A thioverestert werden, damit die GOAT Des-Acyl-Ghrelin zu Serin-3-Acyl-ghrelin acylieren kann.6,7 Ghrelin, modifiziert mit einer Octanoyl- oder Decanoyl-Gruppe, ist der optimale Ligand um GHSR1a zu aktivieren. Wohingegen die Rolle von Des-Acyl-Ghrelin und Acyl-Ghrelin noch unklar ist.4
Es wurde herausgefunden, dass die Halbwertszeit von Acyl-Ghrelin im Serum zwischen 240 Minuten beim Menschen und 30 Minuten bei Ratten variiert. Dies könnte daran liegen, dass die für die Desacylierung und Spaltung von Ghrelin verantwortlichen Enzyme sich von Spezies zu Spezies unterscheiden.8 Die meisten Studien, die sowohl Des-Acyl- als auch Acyl-Ghrelin analysiert haben, fanden heraus, dass der Großteil des zirkulierendem Ghrelins desacyliert ist. Ein Rezeptor für Des-Acyl-Ghrelin wurde aber noch nicht identifiziert. Heute geht man davon aus, dass das gesamte zirkulierende Ghrelin acyliert sein muss. Das Vorhandensein von Des-Acyl-Ghrelin wird als ein Artefakt der Probenhandhabung angesehen.9
Die Sekretion/Verabreichung (i.v.) von Ghrelin stimuliert sowohl Nahrungsaufnahme als auch GH-Sekretion (in vivo und in vitro).10 Wegen seiner Fähigkeit, die Nahrungsaufnahme von Säugetieren zu erhöhen, wurde Ghrelin als das "Hunger-Hormon" bezeichnet. Diese Bezeichnung hat sich nach dem jüngsten Stand der Forschung nicht bewahrheitet. Das Hormon kann vielmehr dazu beitragen, den Körper auf die Nahrungsaufnahme vorzubereiten, indem es die Energiehomöostase, die Magenmotilität und die Magensäureproduktion reguliert. Die Modulation der Energiehomöostase erfolgt durch die Aktivierung orexigener neuronaler Kreisläufe. Darüber hinaus wurde festgestellt, dass Ghrelin den Glukosestoffwechsel, die Modulation von Schlaf und Geschmack, die Unterdrückung der Thermogenese von braunen Fetten, sowie den Schutz vor Muskelschwund und die Verbesserung der kardiovaskulären Funktionen beeinflusst (Abbildung 1).4

Abbildung 1: Schematischer Überblick über die physiologischen Effekte von Ghrelin im menschlichen Körper.4 Adaptiert von: Mol. Metab. 4(6): 437–460 (2015) unter Creative Commons CC-BY Lizenz.
Ghrelin und Adipositas
Eine weitere wichtige Rolle von Ghrelins ist es, Schlüsselenzyme zu stimulieren, die die Fettsäurespeicherung fördern und zu Adipositas führen können. Es wird angenommen, dass Ghrelin als Botenstoff zwischen den Energiespeichern des Körpers und dem Gehirn wirkt. Dabei kann dieser Mechanismus unabhängig von der Nahrungsaufnahme sein, vermittelt durch das sympathische Nervensystem. 11 Es sind vier Mechanismen bekannt, die die Wahrscheinlichkeit einer Ghrelin-induzierten Adipositas erhöhen:10
- Die metabolische Bevorzugung von Kohlenhydraten anstelle von Fett als Energielieferant
- Die Umstellung zu einer fettreichen Ernährung
- Verringerung der Stoffwechselfunktion durch Senkung des Ruhestoffwechsels und der Wärmeproduktion
- Verringerung des Energieverbrauches durch Verringerung der spontanen Bewegungsaktivität
Durch das Verständnis dieser Ghrelin-induzierten Stoffwechselmechanismen und der beteiligten Verbindungen können neue Therapeutika in Betracht gezogen werden. Diese sollten dann auf die genannten und noch aufzuklärenden Stoffwechselfunktionen von Ghrelin abzielen. Außerdem erlangt man damit ein Verständnis über die möglichen Ursachen, die bei adipösen Personen zu einer metabolischen Dysfunktion führen.10 Interessanterweise konnte kein Unterschied in Gewichtszunahme oder im Fressverhalten bei genetisch veränderten Mäusen im Vergleich zum Wildtyp gefunden werden. Diese hatten sowohl eine Deletion des Ghrelin-Gens als auch des GSH-R-Gens.10 Ghrelin Knockout-Mäuse reagierten ebenfalls auf Fasten und ernährungsbedingte Fettleibigkeit wie der Wildtyp. Die Wirkung von Ghrelin auf die Entwicklung von Adipositas und die damit verbundenen Stoffwechselstörungen konnte bei jungen Mäusen beobachtet werden. 18-Wochen alte Mäuse waren hingegen resistent gegen die ernährungsbedingte Adipositas.12 Die Zukunft der Adipositas-Forschung würde also von weiteren Untersuchungen zur Ghrelin-induzierten metabolischen Energiehomöostase profitieren. Jetzt, da wir wissen, wo und wie Ghrelin in einigen Fällen wirkt, ist ein besseres Verständnis seiner Rolle bei der Energieregulierung notwendig, um neue diagnostische und therapeutische Ansätze zu entwickeln.
Referenzen
- World Health Organization article. Obesity and Overweight (2018)
- Tschop M., Smiley D.L., Heiman M.L Ghrelin induces adiposity in rodents. Nature 407, 908-913 (2000).
- Kojima, M., Hosoda, H., Date, Y., et al. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature 402(672),656-660 (1999).
- Müller, T.D., Nogunerias, R., Andermann, M.L., et al., Ghrelin. Mol. Metab. 4, 437-460 (2015).
- Willesen M.G., Kristensen P., Romer J. Co-localization of growth hormone secretagogue receptor and NPY mRNA in the arcuate nucleus of the rat. Neuroendocrinology, 70(5), 306-316 (1999).
- Gutierrez J.A., Solenberg P.J., Perkins D.R., et al., Ghrelin octanoylation mediated by an orphan lipid transferase. Proc. Natl. Acad. Sci. U.S.A. 105(17), 6320-6325 (2008).
- Yang J., Brown M.S, Liang G., et al., Identification of the acyltransferase that octanoylates ghrelin, an appetite-stimulating peptide hormone. Cell, 132(3) 387-396 (2008).
- De Vriese C., Gregoire F., Lema-Kisoka R., et al., Ghrelin degradation by serum and tissue homogenates: Identification of the cleavage sites. Endocrinology 145(11), 4997-5005 (2004).
- Blatnik M., Soderstrom C.I., Dysinger M., et al. Prandial ghrelin attenuation provides evidence that des-acyl ghrelin may be an artifact of sample handling in human plasma. Bioanalysis, 4(20), 2447-2455 (2012).
- Abizaid A. and Horvath T.L Ghrelin and the central regulation of feeding and energy balance. Indian J. Endocrinol. Metab. 16(Suppl. 3), 617-626 (2012).
- Theander-Carrillo C., Wiedmer P., Cettour-Rose P., et al., Ghrelin action in the brain controls adipocyte metabolism. J. Clin. Invest., 116(7), 1983-1993 (2006).
- Wortley K.E., Del Rincon J.P., Murray J.D., et al., Absence of ghrelin protects against early-onset obesity. J. Clin. Invest. 115(12), 3573–35788 (2005).