Verfasst von Emily Locke
Als Beata Halassys Brustkrebs 2020 zum zweiten Mal zurückkehrt, ist sie mit ihren Kräften am Ende. Seitdem der „triple negative“ Tumor – eine eher seltene, aggressive Form von Brustkrebs – vier Jahre zuvor das erste Mal entdeckt wurde, hatte man sie bereits zwei Mal operiert. Sie verlor ihre linke Brust und machte eine harte Chemotherapie durch. Für Beata Halassy stand damals fest: Dieses Prozedere möchte sie kein weiteres Mal durchleben. Also trifft sie eine mutige Entscheidung: Halassy, Molekularbiologin am Kompetenzzentrum für Virusimmunologie und Impfstoffe an der Universität Zagreb in Kroatien, forscht an sogenannten onkolytischen Viren (OVs) – einer neuartigen Form der Immuntherapie gegen Krebs. Kurzerhand beschließt sie, ihren Brustkrebs im Rahmen eines Selbstversuchs mit den Viren aus ihrem eigenen Labor zu behandeln – und das mit großem Erfolg: Heute, fünf Jahre später, ist sie weiterhin tumorfrei [1].
Auch wenn Halassys Fall einerseits eine lebhafte Diskussion in der Fachwelt über die ethischen Implikationen von Selbstversuchen in der Medizin ausgelöst hat, verdeutlicht er andererseits eindrucksvoll das enorme Potenzial onkolytischer Viren im Kampf gegen Krebs [2]. Einer der führenden Experten auf diesem Gebiet in Deutschland ist Prof. Dr. Dr. Guy Ungerechts. Er leitet die Klinische Kooperationseinheit (KKE) Virotherapie am Nationalen Centrum für Tumorerkrankungen (NCT) in Heidelberg und hat bereits über zehn frühe klinische Studien mit verschiedenen onkolytischen Viren durchgeführt [3]. Unsere studentische Mitarbeiterin Emily hatte die besondere Gelegenheit, ein dreimonatiges Praktikum in seiner Abteilung zu absolvieren und dabei genaue Einblicke in das faszinierende Forschungsfeld der Virotherapie zu gewinnen. In diesem Blogartikel gibt sie einen Überblick über die Wirkmechanismen onkolytischer Viren und berichtet von ihrem spannenden Forschungsprojekt.
Diese Themen warten auf Sie:
1) Wenn Krankheit zur Heilung wird – das Doppelleben der Viren
2) Doppelschlag gegen den Krebs: Wie onkolytische Viren Tumoren bekämpfen
3) Mit Masernviren zur Tumorimpfung: Mein innovatives Forschungsprojekt
4) Vom Labor in die Klinik: Translationale Forschung am NCT
Jetzt kostenlos für den Biomol-Newsletter anmelden und keinen Blog-Artikel mehr verpassen!
Wenn Krankheit zur Heilung wird – das Doppelleben der Viren
Viren haben einen schlechten Ruf – spätestens seit der Corona-Pandemie gelten sie in der breiten Öffentlichkeit vor allem als Auslöser von Infektionskrankheiten. Hinzu kommt, dass einige Viren (wie etwa Humane Papillomaviren) sogar Krebs auslösen können und für rund 12% aller Tumorerkrankungen verantwortlich sind [4]. Klingt also alles so, als ob man mit Viren ja nichts am Hut haben möchte. Doch dieser Eindruck täuscht: Viren ausschließlich als Krankmacher zu betrachten, verkennt ihr enormes Potenzial für innovative Therapien und Anwendungen. So werden Viren beispielsweise schon seit längerem als Vektoren in der Gentherapie genutzt, um pathogene Mutationen zu korrigieren. Ebenso dienen abgeschwächte oder inaktivierte Viren als Impfstoffe, die das Immunsystem trainieren und vor Infektionskrankheiten schützen.
Dass bestimmte Viren es darüber hinaus ermöglichen, spezifisch Tumorzellen zu attackieren, war mir lange nicht bewusst. Während meines Studiums der Molekularen Biotechnologie bin ich dem Begriff „onkolytische Virotherapie“ nie begegnet – was wohl daran liegen mag, dass es sich (noch) um ein Nischenthema handelt. Doch da mich Viren und ihre Anwendung in neuartigen Therapien schon immer fasziniert haben, entschied ich mich für ein Forschungspraktikum in diesem Bereich. Schließlich fand ich meinen Platz in der Arbeitsgruppe „Applied ViroTherapeutics“ innerhalb der KKE Virotherapie, die unter der Leitung von Dr. Dr. Mathias Leber steht. Die Gruppe konzentriert sich auf die Entwicklung eines auf dem Masernimpfstamm basierenden effektiven Virotherapeutikums. Im Mittelpunkt stehen dabei die gentechnische Modifikation der Virusgenome und die Erforschung von Kombinationstherapien.
Doppelschlag gegen den Krebs: Wie onkolytische Viren Tumoren bekämpfen
Wie kam man überhaupt auf die ungewöhnliche Idee, Viren gegen Krebs einzusetzen? Der Ursprung reicht zurück bis ins frühe 20. Jahrhundert, als erstmals klinische Fallberichte auftauchten, in denen Patient*innen nach einer Virusinfektion einen vollständigen Rückgang ihrer Tumorerkrankung erlebten. Diese Beobachtungen führten zu der Erkenntnis, dass bestimmte Viren bevorzugt Krebszellen befallen, da diesen die natürlichen Abwehrmechanismen gesunder Zellen fehlen [5]. Diese Entdeckungen legten den Grundstein für das Feld der onkolytischen Virotherapie. Hierbei werden Viren im Labor molekularbiologisch so modifiziert, dass sie gezielt bösartige Zellen infizieren und zerstören. Das direkte „Abtöten“ von Tumorzellen durch virale Infektion, Replikation und Ausbreitung wird als Onkolyse bezeichnet und stellt einen der Hauptwirkungsmechanismen onkolytischer Viren dar. Zusätzlich wirken OVs indirekt, indem sie eine lokale und systemische Anti-Tumor-Immunantwort auslösen. Dies geschieht durch die Freisetzung von Tumorantigenen im Kontext von Gefahr- und Pathogen-assoziierten molekularen Mustern (DAMPs; danger-associated molecular patterns und PAMPs; pathogen-associated molecular patterns), die ein immunogenes Tumormikromilieu erzeugen [6]. Aus diesem Grund zählen onkolytische Viren zu den Krebsimmuntherapien.

Abbildung 1: Übersicht über Schlüsselstrategien und Fortschritte in der Virotherapie (neu angeordnet aus [6]; Reprint unter der Creative Commons Attribution 4.0 International Lizenz). (I) Entwicklung neuartiger onkolytischer Viren durch Testen neuer Stämme/Serotypen und die Generierung von Fitness-Mutanten. (II) Modifikation der Viruskapside und Pseudotypisierung zur Umgehung von Antikörperneutralisation und Verbesserung der Zielgerichtetheit. (III) Integration therapeutischer Transgene wie Suizidgene, Zytokine, Immun-Checkpoint-Antikörper oder tumorassoziierte Antigene, um die therapeutische Wirksamkeit zu erhöhen. (IV) Zielgerichtete Anpassung von Eintritts- und Replikationsmechanismen, bspw. durch Kapsid-Modifikationen oder transkriptionelle Steuerung. (V) Kombinationstherapien mit Radiotherapie, Immuntherapien, Epigenetik, oder gezielten Therapien zur Optimierung der Wirksamkeit. (VI) Klinische Evaluierung onkolytischer Viren in Deutschland, einschließlich Parvoviren, Masernviren, Adenoviren, Vacciniaviren und weiterer Plattformen.
Neben den beiden Hauptmechanismen der onkolytischen Virotherapie zielt die Forschung darauf ab, die Effektivität und Spezifität von OVs durch molekularbiologische Modifikationen weiter zu optimieren (Abb. 1). Dazu gehören unter anderem die Identifikation und Entwicklung neuer Virusstämme oder Serotypen (Abb. 1.I) sowie die Modifikation und Pseudotypisierung der Viruskapside, um die Neutralisation durch Antikörper zu umgehen (Abb. 1.II). Ein weiterer zentraler Ansatz besteht darin, therapeutische Transgene in die viralen Genome einzufügen, um sogenannte „bewaffnete“ OVs zu entwickeln („arming“) (Abb. 1.III). Ergänzend dazu werden Kombinationstherapien mit Immun-, Chemo-, Radio- und zielgerichteten Therapien untersucht (Abb. 1.V). Darüber hinaus arbeiten Wissenschaftler*innen daran, onkolytische Viren gezielt auf Krebszellen auszurichten. Dies kann entweder auf der Ebene des Zelleintritts („entry targeting“) geschehen, beispielsweise durch die Fusion krebsspezifischer Liganden mit viralen Oberflächenproteinen, oder während der Replikation nach dem Zelleintritt („post-entry targeting“) (Abb. 1.IV). Letzteres wird etwa durch die Deletion viraler Gene oder Funktionen erreicht, die für die Replikation in gesunden, nicht aber in Krebszellen benötigt werden [6]. Viele unterschiedliche Virusplattformen werden momentan als OVs entwickelt, darunter Adeno-, Herpes-simplex-, Masern-, Parvo-, Vaccinia- und Vesikuläre Stomatititisviren (Abb. 1.VI).
Mit Masernviren zur Tumorimpfung: Mein innovatives Forschungsprojekt
Wie bereits erwähnt, beschäftigt sich die Forschungsgruppe, in der ich mein Praktikum absolvierte, mit der Entwicklung von onkolytischen Masernviren (oMeV). Beim Begriff „Masern“ denken die Meisten wahrscheinlich erstmal an die hochansteckende, fieberhafte Erkrankung, die vor allem Kinder betrifft. Doch Masernviren haben auch eine andere, überraschend positive Seite: Dank ihres natürlichen Onkotropismus – der Fähigkeit, bevorzugt Krebszellen zu infizieren – gelten sie als vielversprechende Kandidaten für die Virotherapie. In der Forschung werden abgeleitete Varianten der Masernimpfstämme verwendet, die im Zuge ihrer langjährigen klinischen Anwendung bei Kindern und Erwachsenen bereits ein exzellentes Sicherheitsprofil bewiesen haben. Zudem bietet das aus der Familie der Paramyxoviridae stammende, negativsträngige RNA-Virus vielseitige Möglichkeiten zur genetischen Modifikation [7].
Im Rahmen meines Praktikums am NCT hatte ich die großartige Gelegenheit, an der Entwicklung eines oMeV-basierten therapeutischen Krebsimpfstoffs für die Behandlung solider Tumoren mitzuwirken. Das Projekt, das von Dr. Dr. Mathias Leber geleitet und seit über drei Jahren von der medizinischen Doktorandin Juliane Hastedt maßgeblich vorangetrieben wird, verfolgt das Ziel, durch eine oMeV-vermittelte Onkolyse Tumorantigene freizusetzen und damit eine T-Zell-gestützte Anti-Tumor-Antwort auszulösen, um so eine langfristige Immunität zu erreichen (Abb. 2). Obwohl die Idee, therapeutische Krebsimpfstoffe zu entwickeln, bereits seit mehreren Jahrzehnten besteht, verlief die erfolgreiche Umsetzung bislang schleppend. Eine der größten Herausforderungen ist die mangelnde Immunogenität früherer Impfstoffkandidaten, die auf die vielfältigen immunsuppressiven Strategien der Krebszellen zurückzuführen ist [8].

Abbildung 2: Dualer Mechanismus onkolytischer Masernviren (übersetzt aus [7]; Reprint unter der Creative Commons Attribution 4.0 International Lizenz). (1) Onkolyse: Das onkolytische Masernvirus infiziert Tumorzellen, führt zu deren spezifischem Zelltod und setzt Tumorantigene (TAA/TSA), virale Partikel sowie immunmodulatorische Zytokine frei. (2) Anti-Tumor-Immunantwort: Die freigesetzten Tumorantigene werden von dendritischen Zellen aufgenommen, die eine Immunantwort durch Aktivierung von T- und B-Zellen auslösen. Dies wandelt einen "kalten" Tumor in einen "heißen" Tumor um, was zur in situ-Impfwirkung und langfristigen Tumorabwehr beiträgt.
Daher ist eine der Rationalen des Projekts, dass die von uns entwickelten onkolytischen Masernviren die Immunsuppression im Tumormikromilieu (TME; tumor microenvironment) überwinden können. Die oMeV-bedingte Onkolyse resultiert in der Freisetzung von tumorspezifischen (TSA) und -assoziierten (TAA) Antigenen sowie immunogenen PAMPs und DAMPs (Abb. 2.1). Dieser als immunogener Zelltod (ICD; immunogenic cell death) bezeichnete Prozess soll das zuvor immunologisch „kalte“ TME in ein inflammatorisches umwandeln und so Immunzellen zum Infektionsherd locken. Infolge der Erkennung von TAA durch Lymphozyten kann ein gegen den Tumor gerichtetes immunologisches Gedächtnis entstehen, das einen langfristigen Schutz vor einem Tumorrezidiv bieten soll (Abb. 2.2). Dieses Konzept wird daher oft als „in situ-Vakzinierung“ beschrieben [7].
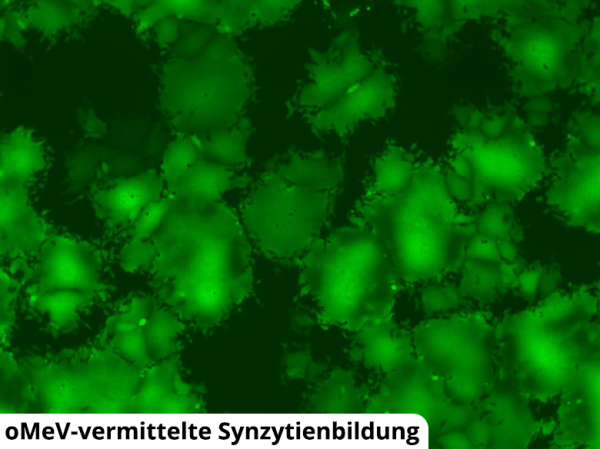
Während meines Praktikums habe ich mich insbesondere mit der Untersuchung und Charakterisierung der Toxizität und Immunogenität der von Juliane Hastedt entwickelten oMeVs beschäftigt. Da unser Masernvirus für das enhanced green fluorescent protein (eGFP) codiert, können wir die Infektion von Tumorzellen sehr gut unter dem Fluoreszenzmikroskop verfolgen. Ein bemerkenswertes Phänomen dabei ist die Bildung sogenannter Synzytien – mehrkerniger Zelleinheiten, die durch die Fusion infizierter Zellen mit benachbarten Zellen entstehen (Abb. 3). Die Verschmelzung der Zellmembranen wird durch die Interaktion der viralen H- und F-Glykoproteine mit zellulären Rezeptoren wie CD46 und CD150 vermittelt. Das Virus nutzt die Synzytienbildung gezielt, um sich effizient von Zelle zu Zelle auszubreiten, ohne dabei die extrazelluläre Umgebung zu durchqueren [9].

Abbildung 3: oMeV-infizierte Vero-Zellen unter dem Fluoreszenzmikroskop. Die Infektion mit dem Masernvirus führt zur Bildung von mehrkernigen Riesenzellen, sogenannten Synzytien.
Vom Labor in die Klinik: Translationale Forschung am NCT
Die Forschungsarbeit in der KKE Virotherapie begeistert mich besonders, da alle Projekte stark translational ausgerichtet sind. Mein Praktikum hat mir nicht nur spannende Einblicke in die Entwicklung onkolytischer Viren ermöglicht, sondern auch gezeigt, wie eng Laborarbeit und klinische Anwendung miteinander verknüpft sind (Abb. 4). Viele der onkolytischen Viren, die von den Forschenden am NCT untersucht werden, kommen als Kandidaten für klinische Studien in Frage. Dabei beschränkt sich die KKE nicht nur auf die Entwicklung innovativer Strategien für effektive OVs, sondern etabliert auch GMP-konforme Herstellungsprozesse für Virotherapeutika und führt klinische Virotherapiestudien durch [3]. Das NCT bietet dafür die ideale Umgebung: Als onkologisches Spitzenzentrum vereint es Patientenversorgung und patientenbezogene Forschung unter einem Dach. So können neu entwickelte Therapien direkt vor Ort in klinischen Studien getestet werden.

Abbildung 4: Einblicke in meinen Laboralltag während des Praktikums. Links: Arbeit im S2-Zellkulturraum. Rechts: Gemeinsame Auswertung eines Experiments mit meiner Betreuerin Juliane Hastedt.
Das große Ziel der KKE Virotherapie ist natürlich, die wirksamsten onkolytischen Immuntherapien in die klinische Anwendung zu bringen. Bislang ist die Liste der zugelassenen onkolytischen Virotherapien noch überschaubar: 2015 wurde Imlygic® (Talimogen Laherparepvec) als erstes OV in den USA und Europa zugelassen. Dieses gentechnisch veränderte Herpes-simplex-Virus, das GM-CSF (Granulozyten-Makrophagen-Kolonie-stimulierender Faktor) exprimiert, wird zur Behandlung des fortgeschrittenen malignen Melanoms eingesetzt [10]. Ein weiteres gentechnisch modifiziertes Herpes-simplex-Virus, Delytact® (Teserpaturev), erhielt 2021 in Japan eine bedingte und zeitlich begrenzte Marktzulassung zur Therapie des malignen Glioms [11]. In der KKE Virotherapie hofft man, dass bald weitere OVs auf der Liste der zugelassenen Therapien stehen. Die Chancen stehen gut: Bis Ende 2023 wurden am NCT bereits zwölf klinische Studien mit insgesamt acht verschiedenen OVs durchgeführt oder initiiert [7]. Und wer weiß – vielleicht wird das onkolytische Masernvirus aus meinem Forschungsprojekt eines Tages ebenfalls den Sprung in die klinische Anwendung schaffen!
Quellen
[1] https://www.zeit.de/gesundheit/2024-11/beata-halassy-selbstversuch-brustkrebs-medizin, 22.01.2025.
[2] Forčić D, Mršić K, Perić-Balja M, Kurtović T, Ramić S, Silovski T, Pedišić I, Milas I, Halassy B. An Unconventional Case Study of Neoadjuvant Oncolytic Virotherapy for Recurrent Breast Cancer. Vaccines (Basel). 2024 Aug 23;12(9):958.
[3] https://www.nct-heidelberg.de/das-nct/kernbereiche/medizinische-onkologie/forschung/virotherapie.html, 22.01.2025.
[4] Ameya G, Birri DJ. The molecular mechanisms of virus-induced human cancers. Microb Pathog. 2023 Oct;183:106292.
[5] Kelly E, Russell SJ. History of oncolytic viruses: genesis to genetic engineering. Mol Ther. 2007 Apr;15(4):651-9.
[6] Nettelbeck, D.M.; Leber, M.F.; Altomonte, J.; Angelova, A.; Beil, J.; Berchtold, S.; Delic, M.; Eberle, J.; Ehrhardt, A.; Engeland, C.E.; et al. Virotherapy in Germany—Recent Activities in Virus Engineering, Preclinical Development, and Clinical Studies. Viruses 2021, 13, 1420.
[7] Dittus, K., Eilert, A.E., Szczeponik, M.G. et al. Onkolytische Viren zur Behandlung von Krebserkrankungen. Biospektrum 29, 585–588 (2023).
[8] https://www.nct-heidelberg.de/das-nct/kernbereiche/medizinische-onkologie/forschung/virotherapie/discover.html, 22.01.2025.
[9] Burton C, Bartee E. Syncytia Formation in Oncolytic Virotherapy. Mol Ther Oncolytics. 2019 Oct 1;15:131-139.
[10] https://www.ema.europa.eu/en/medicines/human/EPAR/imlygic, 22.01.2025.
[11] Frampton JE. Teserpaturev/G47Δ: First Approval. BioDrugs. 2022 Sep;36(5):667-672.
Preview-Bild: Emily Locke, eigene Aufnahme (17.01.2025)