Eine Fluoreszenzsonde ist ein Fluorophor, der so konzipiert ist, dass er sich in einem bestimmten Bereich einer biologischen Probe lokalisiert oder auf einen bestimmten Reiz reagiert. Fluoreszenzsonden ermöglichen es den Forschenden, bestimmte Komponenten komplexer biomolekularer Anordnungen (einschließlich lebender Zellen) mit hoher Empfindlichkeit und Selektivität nachzuweisen. Reaktive Fluoreszenzfarbstoffe werden häufig verwendet, um Aminosäuren, Peptide, Proteine (insbesondere Antikörper), Oligonukleotide, Nukleinsäuren, Kohlenhydrate und andere biologische Moleküle zu modifizieren. AAT Bioquest bietet ein umfassendes Spektrum an Fluorophoren für die Markierung von Biopolymeren und die Derivatisierung von Molekülen mit niedrigem Molekulargewicht.
Unter den Reaktivfarbstoffen werden aminreaktive Farbstoffe am häufigsten zur Herstellung verschiedener Biokonjugate für die Immunchemie, Histochemie, Fluoreszenz-in-situ-Hybridisierung (FISH), Zellverfolgung, Rezeptorbindung und andere biologische Anwendungen verwendet, da Aminogruppen entweder reichlich vorhanden sind oder leicht in Biomoleküle eingeführt werden können. Im Allgemeinen werden thiolreaktive Reagenzien häufig zur Entwicklung von Sonden für die Untersuchung bestimmter Proteinstrukturen und -funktionen verwendet. Darüber hinaus werden einige aminhaltige, fluoreszierende Reagenzien auch zur Modifizierung von Biomolekülen verwendet, insbesondere zur Markierung von Glykoproteinen. Im Allgemeinen sollten die bevorzugten Biokonjugate eine hohe Fluoreszenzquantenausbeute aufweisen und die biologischen Aktivitäten der unmarkierten Biomoleküle beibehalten. Bei der Konjugation von Biopolymeren ist es sehr wichtig, den Substitutionsgrad (DOS, degree of substitution) richtig zu steuern. Ein hoher Labelinggrad kann die Wasserlöslichkeit und die Bindungsaffinität/-spezifität der Ziel-Biomoleküle erheblich verringern. Obwohl die Konjugation von Farbstoffen mit Biomolekülen in der Regel einfach ist, kann die Herstellung des optimalen Konjugats umfangreiche Experimente erfordern. Glücklicherweise gibt es einige hervorragende Veröffentlichungen, die Ihnen einige wichtige Leitlinien an die Hand geben können.
Aminreaktive Fluoreszenzfarbstoffe
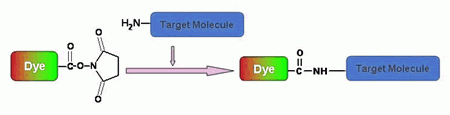
Amin-reaktive Fluoreszenzsonden werden häufig zur Modifizierung von Peptiden, Proteinen, Oligonukleotiden, Nukleinsäuren, Liganden und anderen Biomolekülen verwendet. Aminreaktive Farbstoffe werden am häufigsten zur Herstellung von Biokonjugaten für die Immunchemie, die Fluoreszenz-in-situ-Hybridisierung (FISH), die Zellverfolgung, die Markierung von Rezeptoren und die analoge Fluoreszenzzytochemie verwendet. Bei diesen Anwendungen ist die Stabilität der chemischen Bindung zwischen dem aminreaktiven Farbstoff und dem Biomolekül besonders wichtig, da die fluoreszierenden Konjugate oft strengen Inkubations-, Hybridisierungs- und Waschschritten unterzogen werden. Es wurde eine Reihe von fluoreszierenden, aminoreaktiven Farbstoffen entwickelt, um verschiedene Biomoleküle zu markieren, und die daraus resultierenden Konjugate werden in biologischen Anwendungen häufig eingesetzt. Drei Hauptklassen von aminreaktiven Fluoreszenzreagenzien werden derzeit zur Markierung von Biopolymeren verwendet: Succinimidylester, Isothiocyanate und Sulfonylchloride. AAT Bioquest bietet alle gängigen aminreaktiven Fluoreszenzfarbstoffe für Peptid-/Proteinmarkierungen, Nukleotidmodifikationen und Microarray-Anwendungen an. Obwohl FITC (Fluorescein Isothiocyanat), einer der populärsten Fluoreszenzfarbstoffe, überwiegend für die Herstellung einer Vielzahl von fluoreszierenden Biokonjugaten verwendet wird, sind die geringe Konjugationseffizienz von FITC und die kurze Lebensdauer seiner Konjugate für einige kritische biologische Anwendungen immer noch problematisch. Wir empfehlen dringend, dass Sie Succinimidylester für Markierungszwecke verwenden, wenn andere Bedingungen und Faktoren gleichwertig sind.
Fluoreszierende Farbstoffcarbonsäuren und ihre Succinimidylester
Succinimidylester (SE) haben sich als die besten Reagenzien für Aminmodifikationen erwiesen, da die gebildeten Amidbindungen im Wesentlichen mit den natürlichen Peptidbindungen identisch und daher genauso stabil sind. Diese Reagenzien sind im Allgemeinen stabil und zeigen eine gute Reaktivität und Selektivität mit aliphatischen Aminen. Bei der Verwendung von SE-Verbindungen für Konjugationsreaktionen sollten einige Faktoren berücksichtigt werden:
-
Lösungsmittel: Reaktive Farbstoffe sind in den meisten Fällen hydrophobe Moleküle und sollten in wasserfreiem Dimethylformamid (DMF) oder Dimethylsulfoxid (DMSO) aufgelöst werden.
-
pH-Wert der Reaktion: Die Markierungsreaktionen von Aminen mit SE sind stark pH-abhängig. Aminreaktive Reagenzien reagieren mit nicht-protonierten aliphatischen Amingruppen, einschließlich der terminalen Amine von Proteinen und der ε-Aminogruppen von Lysinen. Daher werden Amin-Acylierungsreaktionen in der Regel bei einem pH-Wert >7,5 durchgeführt. Proteinmodifikationen durch SE können in der Regel bei einem pH-Wert von 7,5-8,5 durchgeführt werden, während Isothiocyanate für optimale Konjugationen einen pH-Wert zwischen 9,0 und 10,0 benötigen.
-
Reaktionspuffer: Puffer, die freie Amine wie Tris und Glycin sowie Thiolverbindungen enthalten, müssen bei der Verwendung eines aminreaktiven Reagenzes vermieden werden. Ammoniumsalze (wie Ammoniumsulfat und Ammoniumacetat), die häufig zur Proteinfällung verwendet werden, müssen vor der Durchführung von Farbstoffkonjugationen ebenfalls entfernt werden (z. B. durch Viadinlyse).
-
Reaktionstemperatur: Die meisten Konjugationen werden bei Raumtemperatur durchgeführt. Für bestimmte Markierungsreaktionen kann jedoch entweder eine höhere oder eine niedrigere Temperatur erforderlich sein.
Fluoreszierende Farbstoff-Sulfonylchloride

Sulfonylchloride (SC) sind sehr reaktionsfreudig. Diese Reagenzien sind in Wasser instabil, insbesondere bei dem für die Reaktion mit aliphatischen Aminen erforderlichen höheren pH-Wert. Molekulare Modifikationen durch SC müssen sorgfältig, vorzugsweise bei niedriger Temperatur, durchgeführt werden. SC können auch mit Phenolen (u. a. Tyrosin), aliphatischen Alkoholen (u. a. Polysacchariden), Thiolen (z. B. Cystein) und Imidazolen (z. B. Histidin) reagieren, aber diese Reaktionen sind bei Proteinen oder in wässriger Lösung nicht üblich. Bei der Verwendung von SC-Verbindungen für Konjugationsreaktionen sind einige Faktoren zu berücksichtigen:
-
Lösungsmittel: SC-Farbstoffe sind im Allgemeinen hydrophobe Moleküle und sollten in wasserfreiem DMF aufgelöst werden. In DMSO sind Sulfonylchloride instabil und sollten niemals in diesem Lösungsmittel verwendet werden.
-
pH-Wert der Reaktion: Die Markierungsreaktionen von Aminen mit SC-Reagenzien sind stark pH-abhängig. SC-Reagenzien reagieren mit nicht-protonierten Amingruppen. Andererseits neigen die Sulfonylierungsreagenzien dazu, in Gegenwart von Wasser zu hydrolysieren, wobei die Geschwindigkeit mit steigendem pH-Wert zunimmt. Daher können Konjugationen auf Sulfonylierungsbasis einen pH-Wert von 9,0-10,0 für optimale Konjugationen erfordern. Im Allgemeinen ist die Ausbeute bei Konjugationen auf Sulfonylierungsbasis wesentlich geringer als bei Konjugationen auf Succinimidylesterbasis.
-
Reaktionspuffer: Puffer, die freie Amine enthalten, wie Tris und Glycin, müssen bei der Verwendung eines aminreaktiven Reagenzes vermieden werden. Ammoniumsulfat und Ammonium müssen vor der Durchführung von Farbstoffkonjugationen entfernt werden. Hohe Konzentrationen von nukleophilen Thiolverbindungen sollten ebenfalls vermieden werden, da sie mit dem Markierungsreagenz reagieren und instabile Zwischenprodukte bilden können, die den reaktiven Farbstoff zerstören könnten.
-
Reaktionstemperatur: Die meisten SC-Konjugationen werden bei Raumtemperatur durchgeführt. Für bestimmte SC-Markierungsreaktionen kann jedoch eine niedrigere Temperatur erforderlich sein.
Fluoreszierende Farbstoff-Isothiocyanate

Isothiocyanate bilden bei der Reaktion mit Aminen Thioharnstoffe. Es ist erwiesen, dass einige Thioharnstoffprodukte (insbesondere die Konjugate aus α-Aminosäuren/Peptiden/Proteinen) viel weniger stabil sind als die Konjugate, die aus den entsprechenden Succinimidylestern hergestellt werden. Es wurde berichtet, dass Antikörperkonjugate, die aus Fluoresceinisothiocyanaten hergestellt wurden, mit der Zeit an Stabilität verlieren. Wir empfehlen nachdrücklich, wann immer möglich Succinimidylester für Ihre Konjugationen zu verwenden. Bei der Verwendung von Isothiocyanat-Verbindungen für die Konjugationsreaktion sind einige Faktoren zu beachten:
-
Lösungsmittel: Reaktive Farbstoffe sind größtenteils hydrophobe Moleküle und sollten entweder in wasserfreiem DMF oder in DMSO gelöst werden.
-
pH-Wert der Reaktion: Die Markierungsreaktionen von Aminen mit Isothiocyanaten sind stark pH-abhängig. Isothiocyanat-Reagenzien reagieren mit nicht-protonierten aliphatischen Amingruppen, einschließlich der terminalen Amine von Proteinen und der ε-Aminogruppen von Lysinen. Proteinmodifikationen durch Isothiocyanate können für optimale Konjugationen einen pH-Wert von 9,0-10,0 erfordern.
-
Reaktionspuffer: Puffer, die freie Amine enthalten, wie Tris und Glycin, müssen bei der Verwendung eines aminreaktiven Reagenzes vermieden werden. Auch Ammoniumsalze müssen vor der Durchführung von Farbstoffkonjugationen entfernt werden. Hohe Konzentrationen von nukleophilen Thiolverbindungen sollten ebenfalls vermieden werden, da sie mit dem Markierungsreagenz reagieren und instabile Zwischenprodukte bilden können, die den reaktiven Farbstoff zerstören könnten.
-
Reaktionstemperatur: Die meisten Isothiocyanat-Konjugationen werden bei Raumtemperatur durchgeführt. Für bestimmte Markierungsreaktionen kann jedoch entweder eine höhere oder eine niedrigere Temperatur erforderlich sein.
Andere aminreaktive Fluoreszenzreagenzien
Arylhalogenide mit Elektronenmangel sind wirksame aminreaktive Markierungsreagenzien für die Herstellung verschiedener Biokonjugate. AAT Bioquest bietet Fluorescamine, NBD-Chlorid, NBD-Fluorid, AAT-Fluorid, SBD-Fluorid sowie 5- und 6-Fluorescein-Dichlortriazine an. Aufgrund ihrer geringen Selektivität reagieren diese Farbstoffe neben Aminogruppen auch mit Thiolresten. 5- und 6-Fluorescein-Dichlortriazine können sogar mit Hydroxyverbindungen wie Kohlenhydraten reagieren.
Das nicht-fluoreszierende NBD-Chlorid reagiert leicht mit primären aliphatischen Aminen (z. B. Aminosäuren) und erzeugt hellgelbe fluoreszierende Aminaddukte. NBD reagiert auch mit Thiolen, obwohl diese Addukte bei kürzeren Wellenlängen absorbieren und emittieren und weniger fluoreszierend sind als Aminderivate. NBD-Fluorid ergibt in der Regel die gleichen Produkte wie NBD-Chlorid, ist aber wesentlich reaktiver. NBD-Fluorid kann unter ungünstigen Bedingungen sogar mit Hydroxygruppen reagieren, wenn keine Amino- oder Thiolgruppen vorhanden sind. Die Absorptions- und Fluoreszenzemissionsspektren, die Quantenausbeuten und die Extinktionskoeffizienten der NBD-Konjugate sind stark von der Umgebung abhängig. Wie bei den Dansyl-Farbstoff-Addukten ist die Fluoreszenz-Quantenausbeute der NBD-Addukte von Aminen in Wasser sehr gering (<0,01). NBD-Addukte von sekundären Aminen sind weniger fluoreszierend als die von primären Aminen, während die Addukte von aromatischen Aminen mit NBD im Wesentlichen nicht-fluoreszierend sind. Bei der Verwendung von Arylhalogeniden mit Elektronenmangel für die Konjugationsreaktion sind einige Faktoren zu berücksichtigen.
-
Lösungsmittel: Arylhalogenide mit Elektronenmangel sind zumeist hydrophobe Moleküle und sollten in wasserfreiem DMF oder DMSO aufgelöst werden.
-
pH-Wert der Reaktion: Die Markierungsreaktionen von Aminen mit elektronenarmen Arylhalogeniden sind stark pH-abhängig. Ein pH-Wert von 7,5-9,5 ist in der Regel optimal für die Modifizierung von Lysinresten.
-
Reaktionspuffer: Puffer, die freie Amine wie Tris und Glycin enthalten, müssen bei der Verwendung eines aminreaktiven Reagenzes vermieden werden. Auch Ammoniumsalze müssen vor der Durchführung von Farbstoffkonjugationen entfernt werden. Hohe Konzentrationen von nukleophilen Thiolverbindungen sollten ebenfalls vermieden werden, da sie leicht mit dem Markierungsreagenz reagieren.
-
Reaktionstemperatur: Die meisten Konjugationen werden bei Raumtemperatur durchgeführt. Für bestimmte Markierungsreaktionen kann jedoch entweder eine höhere oder eine niedrigere Temperatur erforderlich sein.
Thiolreaktive Fluoreszenzfarbstoffe
Da freie Thiolgruppen (SH), auch Mercaptogruppen genannt, in den meisten Biopolymeren wie Proteinen und Nukleinsäuren nicht so häufig vorkommen wie Aminogruppen, bieten thiolreaktive Reagenzien oft die Möglichkeit, ein Protein an einer bestimmten Stelle selektiv zu verändern. Daher werden thiolreaktive Farbstoffe häufig zur Herstellung von fluoreszierenden Peptiden, Proteinen und Oligonukleotiden für die Untersuchung von biologischen Strukturen, Funktionen und Wechselwirkungen verwendet. Thiolreaktive Farbstoffe wurden bereits zur Entwicklung von Sonden für die Analyse der Topographie von Proteinen in biologischen Membranen, zur Bestimmung von Abständen innerhalb des Proteins oder zwischen den Proteinen und zur Überwachung von Veränderungen der Proteinkonformation mit Hilfe umgebungsempfindlicher Sonden verwendet.
In der Literatur sind viele Arten von thiolreaktiven Farbstoffen beschrieben, darunter Iodacetamide, Disulfide, Maleimide, Vinylsulfone und verschiedene Arylhalogenide und -sulfonate mit Elektronenmangel. Iodacetamide und Maleimide sind bei weitem die beliebtesten thiolreaktiven Komponenten.
Fluoreszierende Farbstoff-Iodoacetamide

Iodacetamide (IA) sind eine der beliebtesten thiolreaktiven Komponenten zur Markierung von Biopolymeren und kleinen Biomolekülen. IA reagieren leicht mit Thiolanteilen von Biopolymeren und kleinen Biomolekülen und bilden Thioetherkonjugate. Die gebildete Thioetherbindung ist recht stabil. Obwohl IA im Allgemeinen eine gute Selektivität gegenüber Thiolgruppen aufweisen, können sie bei höherem pH-Wert mit Histidin oder möglicherweise Tyrosin reagieren, wenn freie Thiole nicht ohne weiteres verfügbar sind. Die Biokonjugationsreaktionen thiolreaktiver Sonden können durch Zugabe von Cystein, Glutathion oder Mercaptobernsteinsäure zum Reaktionsgemisch abgeschwächt werden, wobei sich gut wasserlösliche Addukte bilden, die sich leicht durch Dialyse oder Gelfiltration entfernen lassen. Bei der Verwendung von IA für Konjugationsreaktionen müssen einige Faktoren berücksichtigt werden:
-
Lösungsmittel: Die meisten IA-Farbstoffe sind hydrophobe Moleküle und sollten in wasserfreiem DMF aufgelöst werden. DMSO sollte nach Möglichkeit vermieden werden, da einige bestimmte Iodacetamide in DMSO bei erhöhter Temperatur oxidiert werden können.
-
pH-Wert der Reaktion: Die Markierungsreaktionen von Thiolverbindungen mit IA sind stark pH-abhängig. Thiol-reaktive Reagenzien reagieren bei höherem pH-Wert leichter mit Thiolgruppen (wie Cystein und reduziertem Glutathion). Ein höherer pH-Wert erhöht jedoch auch die oxidative Dimerisierung von Thiolverbindungen. Daher werden Thiolkonjugationen von IA häufig in Carbonatpuffern mit einem pH-Wert zwischen 7,5 und 9,5 durchgeführt. Ein pH-Wert von 8,5-9,5 ist in der Regel optimal für die Modifizierung von Cysteinresten.
-
Reaktionspuffer: Puffer, die freie Amine wie Tris und Glycin enthalten, sollten nach Möglichkeit vermieden werden, da einige IA auch mit Aminen reagieren können. Ammoniumsalze sollten vor der Durchführung von Farbstoffkonjugationen entfernt werden. Hohe Konzentrationen von nukleophilen Thiolverbindungen sollten ebenfalls vermieden werden, da sie mit dem Markierungsreagenz konkurrieren und dadurch die Konjugationsausbeute verringern.
-
Reaktionstemperatur: Die meisten Konjugationen werden bei Raumtemperatur durchgeführt. Für bestimmte Markierungsreaktionen kann jedoch entweder eine höhere oder eine niedrigere Temperatur erforderlich sein.
-
Lichtempfindlichkeit: Iodo-Verbindungen sind bekanntermaßen sehr lichtempfindlich, insbesondere in Lösung. Wir empfehlen daher, die Reaktionen von IA mit Biomolekülen unter gedämpftem Licht durchzuführen.
-
Vermeiden von Sauerstoff: Die Oxidation von Thiolverbindungen an der Luft (zu Disulfiden) ist eine wichtige Konkurrenzreaktion für die Iodacetamid-Modifikationen von Thiolkomponenten. Es wird empfohlen, den Kontakt der Reaktionslösung mit Luft so weit wie möglich zu vermeiden.
Fluoreszierende Farbstoff-Maleimide

Maleimide und Iodacetamide sind die bei weitem beliebtesten thiolreaktiven Komponenten. Maleimide reagieren leicht mit Thiolanteilen von Biopolymeren und bilden selbst unter neutralen Bedingungen Thioetherkonjugate. Die gebildete Thioetherbindung ist recht stabil. Maleimide sind im Allgemeinen viel weniger lichtempfindlich als IA. Letztere sind wie erwähnt sehr lichtempfindlich, insbesondere in Lösung.
Maleimide erfordern weniger strenge Konjugationsbedingungen als IA, wie oben beschrieben. Im Gegensatz zu IA reagieren Maleimide unter physiologischen Bedingungen nicht mit Histidin und Methionin. Zum Beispiel können die meisten Konjugationen bei Raumtemperatur und neutralem pH-Wert durchgeführt werden. Für bestimmte Markierungsreaktionen kann jedoch entweder ein höherer oder ein niedrigerer pH-Wert oder eine niedrigere Temperatur erforderlich sein.
Andere thiolreaktive Fluoreszenzfarbstoffe
NBD-Chlorid wurde zunächst als fluorogenes Derivatisierungsreagenz für Amine eingeführt. Es reagiert auch mit Thiolen und bildet Addukte, die bei kürzeren Wellenlängen absorbieren und emittieren. NBD- und SBD-Verbindungen werden häufig für fluorogene Thiol-Modifikationen von Biopolymeren verwendet. Im Allgemeinen werden NBD-Verbindungen häufiger zur Modifizierung von Aminogruppen und SBD-Verbindungen zur selektiven Modifizierung von Thiolgruppen verwendet. Die Absorptions- und Fluoreszenzemissionsspektren, Quantenausbeuten und Extinktionskoeffizienten von NBD-Thiol-Konjugaten sind von der Umgebung abhängig. SBD ist ein Analogon von NBD. SBD-Fluorid wurde für die Derivatisierung sowohl von Amino- als auch von Thiolgruppen verwendet. Über die Anwendungen von SBD-, NBD- und SBD-Verbindungen wurden zahlreiche hervorragende Berichte veröffentlicht. Die meisten NBD- und SBD-Verbindungen reagieren sowohl mit Amino- als auch mit Thiolgruppen, wobei SBD-Cl eine gute Selektivität für Thiolgruppen aufweist. Außerdem werden NBD- und SBD-Verbindungen häufig für HPLC-Derivatisierungen verwendet.
Bromobimane, einschließlich Monobromobiman und Dibromobiman, sind eine weitere Klasse beliebter thiolreaktiver, fluoreszierender Marker und werden häufig zum Nachweis verschiedener thiolhaltiger Biomoleküle wie Glutathion in Zellen verwendet. Die Monobrombimane sind im Wesentlichen nicht-fluoreszierend, bis sie mit verschiedenen Thiolen mit niedrigem Molekulargewicht reagieren, darunter Glutathion, N-Acetylcystein, Mercaptopurin, Peptide und Plasmathiole sowie mit Carbonsäuren. Durch Reaktion mit thiolhaltigen Molekülen werden sie fluoreszierend. Monobromobiman ist das am häufigsten verwendete Bimanderivat. Diese Reagenzien sind auch für den Nachweis der Verteilung von Proteinthiolen in Zellen vor und nach der chemischen Reduktion von Disulfiden nützlich. Sowohl Monobrombiman als auch das stärker thiolselektive Monochlorbiman wurden ausgiebig zum Nachweis von Glutathion in lebenden Zellen verwendet. Monobrombiman kann auch zur Derivatisierung thiolhaltiger Proteine vor der Trennung durch isoelektrische Fokussierung verwendet werden, ohne die elektrophoretische Mobilität der Proteine nennenswert zu verändern. Dibrombiman ist ein interessantes Vernetzungsreagenz für Proteine, da es kaum fluoresziert, bevor nicht beide Alkylierungsgruppen reagiert haben.
Carbonylreaktive (aminhaltige) Fluoreszenzfarbstoffe und ihre Anwendungen
Aminhaltige Farbstoffe werden häufig verwendet, um wasserlösliche Biopolymere (wie Proteine) durch die Bildung von Schiffschen Basen oder reduktive Aminierung zu verändern. Unter ihnen werden vor allem fluoreszierend markierte Kadaverin- und Lysinderivate sowie eine Reihe von Hydraziden zur Modifizierung von Biomolekülen verwendet. Diese Farbstoffe werden für die Modifizierung von Kohlenhydraten, Glykoproteinen und Nukleinsäuren verwendet, die zunächst mit Periodat oxidiert werden, um Aldehyde und Ketone in die Biopolymere einzuführen, die anschließend reduktiv aminiert werden. Die Kombination von Periodat-Oxidation mit reduktiver Aminierung bietet eine effektive Möglichkeit zur ortsselektiven Modifizierung von Biopolymeren. So ist beispielsweise die Periodat-Oxidation der 3-terminalen Ribose eine der wenigen Methoden zur selektiven Modifizierung von RNA. Periodat-oxidierte Ribonukleotide werden durch Reaktion mit fluoreszierenden Hydrazinen und Aminen in fluoreszierende Nukleotid-Sonden umgewandelt.
Aminhaltige Farbstoffe werden auch zur Modifizierung von Biopolymeren (z. B. Proteinen) verwendet, wobei wasserlösliche Carbodiimide (z. B. EDC) eingesetzt werden, um die Carboxygruppen der Biopolymere in Amidgruppen umzuwandeln. Zur Verbesserung der Kopplungseffizienz von EDC-vermittelten Protein-Carbonsäure-Konjugationen können entweder NHS oder NHSS verwendet werden. Für EDC-vermittelte Biokonjugationen in konzentrierten Proteinlösungen bei niedrigem pH-Wert wird in der Regel ein großer Überschuss der aminhaltigen Farbstoffe verwendet, um die intra- und interproteinhaltige Kopplung an Lysinreste, eine häufige Nebenreaktion, zu reduzieren.
Die aminhaltigen Farbstoffe sind auch wertvolle Bausteine in der bioorganischen und medizinischen Chemie. Wir haben unsere aminhaltigen Farbstoffe für die kundenspezifische Synthese vieler fluoreszenzmarkierter Arzneimittel, natürlicher Toxine und biologischer Liganden verwendet.




![MCA [7-Methoxycoumarin-4-acetic acid] MCA [7-Methoxycoumarin-4-acetic acid]](https://www.biomol.com/media/image/a4/a2/1e/ABD-557_200x200.gif)

![6-JOE, SE [6-Carboxy-4,5-dichloro-2,7-dimethoxyfluorescein, succinimidyl ester] 6-JOE, SE [6-Carboxy-4,5-dichloro-2,7-dimethoxyfluorescein, succinimidyl ester]](https://www.biomol.com/media/image/5e/60/7f/ABD-203_200x200.gif)





![6-ROX [6-Carboxy-X-rhodamine] (Single isomer) 6-ROX [6-Carboxy-X-rhodamine] (Single isomer)](https://www.biomol.com/media/image/af/3a/bc/ABD-382_200x200.gif)