Originalartikel von AdipoGen Life Sciences
AdipoGen Life Sciences verbindet Immunologie und Metabolismus und entwickelt Produkte für die Bereiche Krebs, Immunologie, Metabolisches Syndrom (Diabetes, Fettleibigkeit), Stammzellen und Neurodegeneration. Das Spezialgebiet des Unternehmens liegt in der Entzündungsforschung (Inflammation): AdipoGen ist der Experte im Bereich Inflammasom-Forschung. Doch was genau sind Inflammasome eigentlich und welchen Zweck erfüllen Sie? Erfahren Sie in diesem Blog-Artikel mehr über die Funktionsweise dieser essentiellen Multiproteinkomplexe des angeborenen Immunsystems, wie die Aktivierungskaskade abläuft, über die therapeutische Bedeutung der Inflammasome und mit welchen Produkten Sie AdipoGen bei Ihrer Forschung am Inflammasom unterstützen kann.
Jetzt kostenlos für den Biomol-Newsletter anmelden und keinen Blog-Artikel mehr verpassen!
Diese Themen warten auf Sie:
1) Inflammasome: Caspase-1-Aktivierungskaskade
2) Regulierung der Aktivität von Inflammasomen
3) Welche therapeutische Bedeutung haben Inflammasome?
4) Detaillierter Blick auf die Inflammasomen und ihre Signalübertragung
5) Erforschen Sie die Inflammasome − mit Produkten von AdipoGen!
6) NLRP3-Inflammasom-Startersets
7) KO-Extrakt-validierte Antikörper − von Experten verwendet und veröffentlicht!
8) Tipps für Ihre NLRP3-Western Blot-Experimente
9) Inflammasom-Aktivatoren und -Inhibitoren − einschließlich eines neuen Gasdermin-Inhibitors
10) Priming-Schritt der Inflammasom-Aktivierung
Inflammasome: Caspase-1-Aktivierungskaskade
Ein Inflammasom ist ein hochmolekularer Komplex, der entzündliche Caspasen und Zytokine der IL-1-Familie aktiviert. Es wurden mehrere Inflammasome beschrieben, die bisher durch das in ihnen enthaltene NLR-Protein definiert wurden: das NLRP1 (NALP1)-Inflammasom, das NLRP3 (NALP3)-Inflammasom und das IPAF (NLRC4)-Inflammasom. Interessanterweise enthält das kürzlich beschriebene AIM2-Inflammasom (absent in melanoma 2) kein einziges Mitglied der NLR-Familie. Inflammasome können durch verschiedene Signale aktiviert werden, darunter lebende Bakterien, mikrobielle Toxine, Xeno-Verbindungen, PAMPs und DAMPs. Es wird angenommen, dass die LRR-Domänen von NLRP3 die Autorepression vermitteln, wahrscheinlich durch SGT1- und HSP90-Chaperone, die NLRP3 in einem inaktiven, aber signalfähigen Zustand halten. Bei Erkennung ihrer jeweiligen Liganden oligomerisieren NLRP1 oder NLRP3 über die NACHT-Domäne, was aufgrund homotypischer PYD-PYD-Wechselwirkungen zur PYD-Clustering und zur Rekrutierung des Adapterproteins ASC (apoptosis-associated speck-like protein containing a CARD) führt. Im Fall von AIM2 wird die Oligomerisierung wahrscheinlich durch Clustering an mehreren Bindungsstellen innerhalb der dsDNA und nicht durch eine zentrale Oligomerisierungsdomäne wie NACHT vermittelt.
Die AIM2-Oligomerisierung führt jedoch auch zur Rekrutierung von ASC über homotypische PYD-PYD-Wechselwirkungen. ASC enthält eine N-terminale PYD-Domäne und eine C-terminale CARD-Domäne, die die Rekrutierung von inflammatorischen Caspasen durch homotypische CARD-CARD-Interaktionen ermöglicht. Auf diese Weise werden inflammatorische Caspasen in unmittelbare Nähe gebracht, was eine Autoaktivierung und die Bildung der aktiven Caspase ermöglicht. Im Falle von Procaspase-1 wird nach der Autospaltung ein p10/p20-Tetramer gebildet. Neben Caspase-1 kann NLRP1 auch Caspase-5 in den Komplex rekrutieren, aber die Rolle von Caspase-5 ist noch umstritten.
Im Gegensatz zu NLRP1, NLRP3 und AIM2 rekrutiert IPAF kein Adaptermolekül, sondern interagiert über seine CARD-Domäne direkt mit Procaspase-1 (Abb. 1). Je nach IPAF-Stimulus kann die maximale Caspase-1-Aktivierung stromabwärts von IPAF jedoch ASC oder NAIP erfordern. Die Bildung der verschiedenen Inflammasomen löst eine gemeinsame nachgeschaltete Kaskade aus, nämlich die Aktivierung von Entzündungs-Caspasen. Dazu gehören Caspase-1, -4 und -5 beim Menschen und Caspase-1, -11 und -12 bei der Maus. Caspase-1 scheint jedoch die dominierende inflammatorische Caspase in Verbindung mit Inflammasomen zu sein. Die inflammatorischen Caspasen haben alle eine CARD-Domäne, gefolgt von einer Domäne, die den katalytischen Rest Cystein enthält, und werden als inflammatorische Caspasen bezeichnet, weil ihre Hauptsubstrate Zytokine (wie pro-IL-1β, pro-IL-18 und schließlich pro-IL-33) sind, die in ihre aktive und sezernierte Form gespalten werden. Darüber hinaus kann die Aktivierung des Inflammasoms bei bestimmten Zelltypen zum Tod der Wirtszelle führen, was als Pyroptose bezeichnet wird. Es wird angenommen, dass die Pyroptose eine wichtige Rolle bei der Begrenzung der intrazellulären Replikation von invasiven Pathogenen spielt.

Abbildung 1: Gefahrensignale oder bakterielle Verbindungen als Aktivatoren von Inflammasomen und NODs ("nucleotide-binding oligomerization domain").
Regulierung der Aktivität von Inflammasomen
Obwohl die Mechanismen, die die Aktivität des Inflammasoms regulieren, nach wie vor schwer fassbar sind, wurden verschiedene Proteine identifiziert, die die Aktivierung des Inflammasoms und die vom Inflammasom abhängige Verarbeitung der entzündlichen Caspasen beeinträchtigen können. Im Allgemeinen lassen sich zwei Subtypen von Inflammasom-Regulatoren unterscheiden - solche, die eine CARD-Domäne enthalten, und solche mit einer PYD-Domäne. Zu diesen Proteinen gehören nicht nur vom Wirt stammende Inflammasom-Regulatoren, sondern auch verschiedene bakterielle Virulenzfaktoren, die die Aktivierung von Caspase-1 hemmen, sowie virale PYD-Proteine.
Welche therapeutische Bedeutung haben Inflammasome?
Da IL-1β und andere Zytokine Schlüsselakteure bei der Entzündungsreaktion sind, liegt die Vermutung nahe, dass IL-1β, entzündliche Caspasen und Inflammasomen bei mehreren Krankheiten eine wichtige Rolle spielen (Abb. 2). In der Tat wurde ein Zusammenhang zwischen einigen menschlichen erblichen oder erworbenen Krankheiten und erhöhtem IL-1β festgestellt, von denen manche mit Antagonisten gegen IL-1β oder seinen Rezeptor behandelt werden können. Eine Reihe von Krankheiten, die als Cryopyrin-assoziierte periodische Syndrome (CAPS) bekannt sind, wurden direkt mit NLRP3-Mutationen in Verbindung gebracht. Darüber hinaus wird Gicht, eine autoinflammatorische Krankheit, die durch schwere Gelenkentzündungen gekennzeichnet ist, neben anderen Merkmalen mit der Ablagerung von Mononatriumurat (MSU)-Kristallen in den Gelenken assoziiert. Da MSU ein potenter NLRP3-Inflammasom-Agonist ist, geht man davon aus, dass das durch das Inflammasom regulierte IL-1β eine pathogene Rolle bei Gicht ausübt. Außerdem wird die IL-1β-Sekretion durch das NLRP3-Inflammasom durch hohe extrazelluläre Glukose in b-Zellen ausgelöst.

Abbildung 2: Überblick über Inflammasom-assoziierte Krankheiten.
Erhöhtes IL-1β ist ein Risikofaktor für die Entwicklung von Typ-2-Diabetes mellitus (T2DM) und trägt zur Insulinresistenz bei, so dass das NLRP3-Inflammasom durch seine Funktion als Sensor für metabolischen Stress, z. B. in Form von MSU oder Hyperglykämie, wahrscheinlich zur Pathogenese von Gicht bzw. T2DM beiträgt. Bei Patienten mit FMF (familiäres Mittelmeerfieber) wurde eine Mutation von Pyrin nachgewiesen. Erhöhte IL-1β-Werte bei der autoinflammatorischen Krankheit PAPA (pyogene Arthritis, Pyoderma gangrenosum und Akne) werden mit Mutationen in PSTPIP1, einem mit Pyrin interagierenden Protein, in Verbindung gebracht. Dies deutet auf die Bedeutung von Pyrin- und Inflammasom-Regulatoren bei autoinflammatorischen Erkrankungen hin und könnte neue Ansatzpunkte für die Behandlung von Krankheiten bieten.
Detaillierter Blick auf die Inflammasomen und ihre Signalübertragung
NLRP1-Inflammasom
Vor Kurzem wurde gezeigt, dass die anti-apoptotischen Proteine Bcl-2 und Bcl-XL an NLRP1 binden und dadurch hemmen können, indem sie die ATP-Bindung an NLRP1 hemmen, was für die Oligomerisierung erforderlich ist. Darüber hinaus wurde gezeigt, dass Bcl-XL die NLRP1-Oligomerisierung unterdrückt, wodurch entzündliche Caspasen nicht in die Nähe gebracht werden. Dies wirkt sich negativ auf die Autoaktivierung von Caspase-1 und die anschließende Verarbeitung von pro-inflammatorischen Zytokinen aus. Zusätzlich zu diesen potenziellen NLRP1-Aktivitätsregulatoren scheint der K+-Efflux für die NLRP1-Aktivierung wesentlich zu sein.
NLRP3/NALP3-Inflammasom
Auch wenn der genaue Mechanismus der NLRP3/NALP3-Inflammasom-Aktivierung noch immer umstritten ist, werden von Forschenden drei Modelle favorisiert:
1) Der NLRP3-Inflammasom-Agonist, extrazelluläres ATP, bindet an seinen Rezeptor P2X7, was den K+-Efflux und die Bildung der Pannexin-1-Membranpore auslöst. Letzteres kann den Eintritt von extrazellulären Faktoren ermöglichen, die direkte NLRP3-Aktivatoren sein können. Es wird auch vermutet, dass NLRP3 den K+-Efflux oder die Membranintegrität wahrnimmt.
2) Phagozytierte kristalline oder partikelförmige NLRP3-Liganden wie MSU, Alaun, Siliziumdioxid und Asbest können eine lysosomale Destabilisierung und Ruptur aufgrund eines mechanischen Insults verursachen, was zur Freisetzung von lysosomalen Inhalten in das Zytosol führt. Da dieser Signalweg empfindlich auf den Cathepsin-B-Inhibitor CA-074-Me reagiert, wurde vermutet, dass Cathepsin B, eine lysosomale Protease, an der Aktivierung eines direkten NLRP3-Liganden beteiligt ist. In Makrophagen mit Cathepsin-B-Mangel wurde jedoch keine veränderte IL-1β-Sekretion und Caspase-1-Spaltung als Reaktion auf NLRP3-Liganden wie MSU oder Alaun beobachtet. Es ist noch nicht bekannt, wie NLRP3 den zytoplasmatischen lysosomalen Inhalt erkennt.
3) Das dritte Modell beinhaltet die Produktion von reaktiven Sauerstoffspezies (ROS). Alle getesteten NLRP3-Agonisten führen zur Produktion von ROS, und darüber hinaus unterdrücken ROS-Scavenger die NLRP3-Aktivierung. Die zelluläre Quelle von ROS ist derzeit nicht bekannt, und obwohl ROS für die NLRP3-Inflammasom-Aktivierung notwendig zu sein scheint, ist sie nicht ausreichend. In b-Zellen wurde gezeigt, dass TXNIP (thioredoxin-interacting protein; VDUP1), ein ROS-empfindlicher NLRP3-Ligand, an der Auslösung der NLRP3-Aktivierung beteiligt ist.
Ein weiterer wichtiger Parameter bei der NLRP3-Aktivierung scheint, wie bei NLRP1, die zytoplasmatische K+-Konzentration zu sein. Die Tatsache, dass Makrophagen, die in hoher K+-Konzentration kultiviert werden, eine verringerte NLRP3-abhängige Caspase-1-Aktivierung aufweisen, deutet wahrscheinlich darauf hin, dass der K+-Efflux der NLRP3-Aktivierung vorgeschaltet sein muss.
IPAF-Inflammasom
Das IPAF-Inflammasom wird durch gramnegative Bakterien aktiviert, die ein funktionelles T3SS oder T4SS besitzen, wie S. typhimurium, S. flexneri, L. pneumophila und P. aeruginosa. Ursprünglich wurde gezeigt, dass zytosolisches Flagellin die IPAF-Inflammasom-Aktivität auslöst. Da jedoch auch nichtflagellierte Bakterien wie S. flexneri eine IPAF-Inflammasom-Aktivierung auslösen, ist es sehr wahrscheinlich, dass es noch andere IPAF-Agonisten gibt. Wie NLRP3 bindet auch IPAF nachweislich SGT1 und HSP90. Im Gegensatz zu NLRP1 und NLRP3 wird die IPAF-Aktivierung nicht durch eine hohe extrazelluläre K+-Konzentration gehemmt, was darauf hindeutet, dass IPAF kein Sensor für Ionenflüsse ist. Allerdings wurde bisher keine direkte Liganden-Rezeptor-Interaktion beobachtet.
AIM2-Inflammasom
Das Mitglied der HIN-200-Familie, AIM2, fungiert als Sensor für zytosolische bakterielle, virale und Wirts-dsDNA und löst durch die Bildung des AIM2-Inflammasoms eine Entzündungsreaktion aus. Es wird angenommen, dass AIM2 über seine C-terminale HIN-200-Domäne direkt an dsDNA bindet. Da AIM2 auch Wirts-dsDNA erkennt, könnte es an Autoimmunerkrankungen beteiligt sein. Die Entdeckung des AIM2-Inflammasoms ist nicht nur deshalb bemerkenswert, weil AIM2 das erste Nicht-NLR-Familienmitglied ist, das ein Inflammasom bildet, sondern auch, weil AIM2 der erste Inflammasom-Rezeptor ist, der direkt mit seinem Liganden interagiert.

Abbildung 3: Inflammasom-Signalübertragung − jetzt herunterladen oder Kopie anfordern.
Erforschen Sie die Inflammasome − mit Produkten von AdipoGen!
Mit unserem Partner AdipoGen Life Sciences erhalten Sie eine breite Palette an hochwertigen Produkten, um Ihre Inflammasom-Forschung voranzutreiben. Die Standardmethode zum Nachweis der Inflammasom-Aktivierung ist Immunoblotting für Caspase-1. Nutzen Sie zur Inflammasom-Messung die Standard-Anti-Caspase-1-Antikörper von Adipogen oder machen Sie Gebrauch von den neuen NLRP3-Inflammasom-Startersets als eine All-in-One-Lösung zur Untersuchung des NLRP3-Inflammasoms mittels Western-Blotting. Laden Sie AdipoGens neue Inflammasom-Broschüre herunter und entdecken Sie die gesamte Produktpalette!
NLRP3-Inflammasom-Startersets
| Produktnummer | Produktname | Beschreibung |
| AG-44B-0008-KI01 | NLRP3 Inflammasome Human Antibodies Starter Set | Das NLRP3-Inflammasom-Antikörper-Starterset (human) ist eine All-in-One-Lösung zur Untersuchung des NLRP3-Inflammasoms mittels Western-Blotting. Dieses Antikörper-Starterset enthält AdipoGens KO-Extrakt-validierte STANDARD-Antikörper gegen die Schlüsselkomponenten des NLRP3-Inflammasoms, einschließlich NLRP3, Asc und Caspase-1, die von den Experten der Inflammasomforschung verwendet und veröffentlicht wurden. Dieses kostengünstige Starterset enthält genügend primäre Antikörper für mindestens 3 Western-Blot-Experimente. |
| AG-44B-0009-KI01 | NLRP3 Inflammasome Mouse Antibodies Starter Set | Das NLRP3-Inflammasom-Antikörper-Starterset (Maus) ist eine All-in-One-Lösung zur Untersuchung des NLRP3-Inflammasoms mittels Western-Blotting. Dieses Antikörper-Starterset enthält Adipogens KO-Extrakt-validierte STANDARD-Antikörper gegen die Schlüsselkomponenten des NLRP3-Inflammasoms, einschließlich NLRP3, Asc und Caspase-1, die von den Experten der Inflammasomforschung verwendet und veröffentlicht wurden. Dieses kostengünstige Starterset enthält genügend primäre Antikörper für mindestens 3 Western-Blot-Experimente. |
| AG-44B-0010-KI01 | NLRP3 Inflammasome Human Reagents Starter Set | Das NLRP3-Inflammasom-Reagenzien-Starterset (human) ist eine All-in-One-Lösung für die Untersuchung des NLRP3-Inflammasoms mittels Western-Blotting. Dieses Reagenzien-Starterset enthält AdipoGens KO-Extrakt-validierte STANDARD-Antikörper gegen die Schlüsselkomponenten des NLRP3-Inflammasoms, einschließlich NLRP3, Asc und Caspase-1, die von den Experten der Inflammasomforschung verwendet und veröffentlicht wurden. Darüber hinaus enthält es zwei chemische Verbindungen für das Priming und die Aktivierung des NLRP3-Inflammasoms. Dieses kostengünstige Starterset enthält genügend primäre Antikörper für mindestens 3 Western-Blot-Experimente. |
| AG-44B-0011-KI01 | NLRP3 Inflammasome Mouse Reagents Starter Set | Das NLRP3-Inflammasom-Reagenzien-Starterset (Maus) ist eine All-in-One-Lösung für die Untersuchung des NLRP3-Inflammasoms mittels Western-Blotting. Dieses Reagenzien-Starterset enthält AdipoGens KO-Extrakt-validierte STANDARD-Antikörper gegen die Schlüsselkomponenten des NLRP3-Inflammasoms, einschließlich NLRP3, Asc und Caspase-1, die von den Experten der Inflammasomforschung verwendet und veröffentlicht wurden. Darüber hinaus enthält es zwei chemische Verbindungen für das Priming und die Aktivierung des NLRP3-Inflammasoms. Dieses kostengünstige Starterset enthält genügend primäre Antikörper für mindestens 3 Western-Blot-Experimente. |
KO-Extrakt-validierte Antikörper − von Experten verwendet und veröffentlicht!
| Produktnummer | Produktname | Anwendungen | Wirt | Reaktivität |
| AG-20B-0042-C100 | Anti-Caspase-1 (p20) (mouse), clone Casper-1 | WB, IHC, IP | Maus | Maus |
| AG-20B-0044-C100 | Anti-Caspase-1 (p10) (mouse), clone Casper-2 | WB | Maus | Maus |
| AG-20B-0048-C100 | Anti-Caspase-1 (p20) (human), clone Bally-1 | WB | Maus | human |
| AG-20B-0014-C100 | Anti-NLRP3/NALP3, clone Cryo-2 | IHC, IP, WB, ICC, ChIP | Maus | human, Maus |
| AG-20B-0084-C100 | Anti-NLRP1b (mouse), mAb (2A12) | WB | Maus | Maus, Ratte |
| AG-25B-0006-C100 | Anti-Asc, pAb (AL177) | ICC, IHC, IP, WB, FA, FC | Kaninchen | human, Maus |
| AG-20B-0009-C100 | Anti-RIG-I, clone Alme-1 | IHC, IP, WB | Maus | human, Maus |
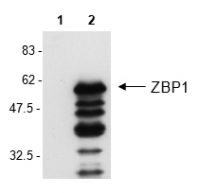
| AG-20B-0010-C100 | Anti-ZBP1, clone Zippy-1 | ICC, IP, WB | Maus | human, Maus |
Tipps für Ihre NLRP3-Western Blot-Experimente
i) Zellen oder Gewebe:
- Überprüfen Sie in der Literatur, ob die verwendeten Primärzellen, Gewebe oder Zelllinien NLRP3 in nachweisbaren Mengen exprimieren. Ein Priming mit LPS, PMA oder anderen Priming-Reagenzien (die die NF-κB-Signalgebung aktivieren) kann durchgeführt werden, um die NLRP3-Spiegel zu erhöhen.
- NLRP3 wird in vielen verschiedenen Zellen oder Geweben exprimiert, aber in einigen Fällen (z.B. unerwartete Mutationen in einigen Zellsubklonen) kann die NLRP3-Konzentration reguliert werden, was zu keinem oder einem schwächeren Signal im WB führt.
ii) SDS-PAGE-Gel:
- Der Prozentsatz der SDS-PAGE sollte optimal <8% betragen.
- Alle Puffer (Laufpuffer, Stapelpuffer, Transferpuffer) sollten frisch hergestellt werden.
- Mindestens 20-30 µg pro Lane laden.
- Der Transfer ist wichtig, da NLRP3 ein schwieriges Protein ist, das sich nicht so leicht transferieren lässt.
- Der Transfer sollte über Nacht bei 20 V und 4 °C in einem Nasstankgerät durchgeführt werden.
- Ein Transfer für 1 Stunde und auch trockene oder halbtrockene Geräte werden NICHT empfohlen.
iii) Primärantikörper:
- Verwenden Sie frisch angesetzten Antikörper Anti-NLRP3 (clone Cryo-2) in einer Verdünnung von 1/1000. Bei schwach exprimiertem Protein kann eine geringere Verdünnung, z. B. 1/500, verwendet werden.
iv) Sekundärantikörper:
- Verwenden Sie einen frisch zubereiteten Anti-Maus-IgG-Antikörper (AG-29B-0004E-R050), der an HRP gekoppelt ist (1/5000) (oder die vom Hersteller empfohlene Verdünnung, wenn ein anderer sekundärer Anti-Maus-IgG-HRP verwendet wird).
v) Positivkontrollen:
- Als Positivkontroll-Zelllinien (die mit ATP, PMA oder LPS geprimt werden können, um den NLRP3-Spiegel zu erhöhen) empfiehlt AdipoGen humane monozytenähnliche Zellen wie THP1 oder U937 und makrophagenähnliche Zellen der Maus Raw264.7 oder monozyten-/makrophagenartige Zellen der Maus J774A.1.
Anmerkungen:
- Der Anti-NLRP3-Antikörper (Cryo-2) von Adipogen ist einer der ganz wenigen NLRP3-Antikörper, die anhand von KO-Extrakten validiert wurden. Viele auf dem Markt befindliche Antikörper sind nicht validiert und haben sich als unspezifisch erwiesen.
- Der Adipogen Anti-NLRP3-Antikörper (Cryo-2) weist die N-terminale Pyrin-Domäne nach.
Inflammasom-Aktivatoren und -Inhibitoren − einschließlich eines neuen Gasdermin-Inhibitors
| Produktnummer | Produktname | Beschreibung |
| AG-CR1-3950-M002 AG-CR1-3951-M010 |
Monosodium urate (crystals) Monosodium urate (ready-to-use) |
Potenter NLRP3-Inflammasom-Aktivator. |
| AG-CN2-0020-M005 | Nigericin, sodium salt | Potenter NLRP3-Inflammasom-Aktivator. |
| AG-CN2-0489-M250 | N-Acetyl-D-glucosamine | Wirkt als Aktivator des NLRP3-Inflammasoms, indem es das Enzym Hexokinase von den Mitochondrien abspaltet. |
| AG-CR1-3705-M005 | Necrosulfonamide | Bindet direkt an Gasdermin D und hemmt die Oligomerisierung des N-Terminus und damit die Porenbildung und Pyroptose. |
| AG-CR1-3698-M001 | U-73122 | Gasdermin D N-terminales Fragment (GSDMD-N)-induzierter Pyroptose-Inhibitor. Schützt vor GSDMD-N-Zytotoxizität in Makrophagen oder vor tödlichen Infektionen bei Mäusen. |
| AG-CR1-3535-M010 | Dapansutrile Bulk-Bestellungen möglich |
Potenter, selektiver und oral wirksamer NLRP3-Inflammasom-Inhibitor. Bindet direkt an das ATP-bindende Motiv der NLRP3-NACHT-Domäne und hemmt die NLRP3-Inflammasom-Zusammensetzung und -Aktivierung. |
| AG-CR1-3615-M001 | MCC950 . Na Bulk-Bestellungen möglich |
Wirksamer und selektiver NLRP3-Inflammasom-Inhibitor. |
| AG-CN2-0459-M010 | Isoliquiritigenin | Hemmt die NLRP3-aktivierte ASC-Oligomerisierung. Blockiert die Initialisierungs- und Aktivierungsschritte. |
| AG-CR1-0013-M010 | BAY 11-7082 | Reduziert die ATPase-Aktivität des NLRP3-Inflammasoms. |
| AG-CR1-3616-M025 AG-CR1-3617-M025 CDX-H0080-G001 |
(R)-3-Hydroxybutyric acid (S)-3-Hydroxybutyric acid DL-3-Hydroxybutyric acid sodium salt |
Verhindern den K+-Efflux und reduzieren somit die ASC-Oligomerisierung. |
| AG-CR1-0158-M001 | K777 [K11777] | Breit angelegter Cathepsin-Inhibitor, der zur Hemmung von Inflammasomen geeignet ist. |
Priming-Schritt der Inflammasom-Aktivierung
Die wichtigste Funktion des NLRP3-Inflammasoms ist die Verarbeitung und Aktivierung von pro-Interleukin-1β (pro-IL-1β). Die meisten Zellen exprimieren jedoch kein pro-IL-1β, so dass eine vorherige Expression von pro-IL-1β erforderlich ist. Dies kann durch die Stimulierung von Rezeptoren wie TLRs (z. B. durch LPS oder PMA), NODs, TNF-Rs (z. B. durch TNF-α) oder IL-1R1 (durch IL-1α und IL-1β) erreicht werden, die NF-κB aktivieren und die Transkription von pro-IL-1β einleiten. Dieser Prozess wird als Priming bezeichnet. Priming induziert auch die NF-κB-abhängige Transkription von NLRP3. AdipoGen Life Sciences bietet gebrauchsfertige LPS-Lösungen & PMA für die Aktivierung des Inflammasoms an. So können Sie sich die Zeit und Mühe bei Ihren Versuchen sparen.
- Kdo2-Lipid A (ready-to-use) (DER STANDARD)
- LPS (Universal) from S. abortus equi (S-form) TLRpureTM Sterile Solution (DER STANDARD)
- LPS from E. coli R515 (Re) TLRpureTM Sterile Solution (DER STANDARD)
- LPS from E. coli O8:K27 (S-form) TLRpureTM Sterile Solution
- LPS from S. minnesota R345 (Rb) TLRpureTM Sterile Solution
- LPS from S. minnesota R595 (Rb) TLRpureTM Sterile Solution
Entdecken Sie außerdem AdipoGens Auswahl an TNF-α-Proteinen für die Aktivierung des Inflammasoms: