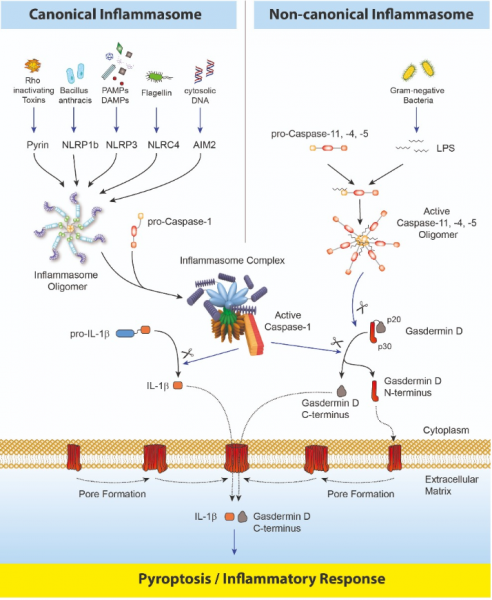
Inflammasome sind Multiproteinkomplexe, die einen Sensor (z.B. NLRP3), einen Adapter (ASC/Pycard) und eine Protease (pro-caspase-1) enthalten.1 Ein Inflammasom bildet sich als Reaktion auf eine Vielzahl von Pathogen-Associated/- Danger-Associated Molecular Patterns (PAMPs/ DAMPs) oder durch Störungen der zytoplasmatischen Homöostase (engl. "Homeostasis-Altering Molecular Processes" (HAMPs)).2 Das Inflammasom aktiviert u.a. Caspase-1, was die Entwicklung von Interleukin-1β und -18 (IL-1β und IL-18) durch proteolytische Spaltung von Pro-IL-1β und Pro-IL-18 fördert. Das 2001 entdeckte, aber erst kürzlich einer Funktion zugeordnete intrazelluläre Protein Gasdermin D wird durch die aktivierte Caspase-1, aber auch durch die im nicht- kanonischen Inflammasom vorkommende Caspase-11 gespalten.3,4 Die Proteine der Gasdermin-Familie enthalten N-terminale Domänen, die in der Lage sind, Membranporen zu bilden. Die C-terminalen Domänen von Gasderminen wirken dagegen als Inhibitoren der Zytolyse durch intramolekulare Domänenassoziation.
Die Caspase-1 oder Caspase-11-Spaltung von Gasdermin D ist Voraussetzung für die Regulierung der Pyroptose: Bei der Caspase-1/11-Spaltung des Gasdermin N- und C-Domänen-Linkers oligomerisiert das N-terminale Fragment und bildet Poren in der Wirtszellmembran.5 Dieser Prozess führt zu einem Zelltod namens Pyroptose und einer weiteren Aktivierung von Inflammasomen durch den Ausstrom von K+-Ionen.6 Aus Gasdermin D gebildete Poren regulieren die nicht-konventionelle Sekretion von Zytokinen wie IL-1β als Reaktion auf zytosolische LPS und anderen Aktivatoren des Inflammasoms.7 Das Ausstoßen von Neutrophil Extracellular Traps (NETs) und der damit einhergehende Zelltod (NETose) sind abhängig von Gasdermin D-Spaltung durch Caspase-11. NETose ist eine besondere neutrophile Abwehr von Krankheitserregern.8 Gasdermin D-ausgelöste Pyroptose wird durch Lipidperoxidation9 reguliert und scheint ein Schlüsseleffektor bei der LPS-induzierten tödlichen Sepsis zu sein.10
Caspase-8, ein vorgeschalteter Aktivator von Caspase-3, kontrolliert den apoptotischen Zelltod und verhindert die RIPK3-MLKL-abhängige Nekroptose. Caspase-8, aktiviert durch das Yersinia-Effektorprotein YopJ, löst auch die Gasdermin D-Verarbeitung und den Zelltod bei verschiedenen Yersinia-Arten aus.11
Obwohl die Porenbildung durch das N-terminale Fragment von Gasdermin D aufgeklärt wurde, bleibt die Rolle des C-terminalen Fragments von Gasdermin D weiterhin unklar. Mit dem Gasdermin D (mouse) ELISA-Kit, lässt sich der C-terminale Teil von Gasdermin D (sowie das vollständige Protein) detektieren. Wird im Überstand von pyroptotisch sterbenden Zellen ein Signal detektiert, so deutet dies auf das Vorhandensein eines Transporters/einer Pore hin. Gasdermin D könnte entweder zufällig oder für eine bestimmte, noch nicht eindeutige Aufgabe, aus den Zellen transportiert worden sein.
Gasdermin D (mouse) ELISA Kit
Das Gasdermin D (mouse) ELISA Kit detektiert murines full-length Gasdermin D sowie die gespaltene Variante (C-Terminus) in Zellkultur-Überständen und Zellextrakten. Es weist keine Kreuzreaktion mit humanem Gasdermin D auf.

- Detektierung: Colorimetrisch
- Assay Typ: Sandwich ELISA
- Probe: Zellkultur-Überstand, Zell-Lysat
- Sensitivität: 14 pg/ml
- Konzentrationsbereich: 15,6 bis 1000 pg/ml
Referenzen
- The inflammasome: a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta: F. Martinon, et al.; Mol. Cell 10, 417 (2002)
- Homeostasis-altering molecular processes as mechanisms of inflammasome activation: A. Liston & S.L. Masters; Nat. Rev. Immunol. 17, 208 (2017)
- Caspase-11 cleaves gasdermin D for non-canonical inflammasome signalling: N. Kayagaki, et al.; Nature 526, 666 (2015)
- Mechanisms of Gasdermin Family Members in Inflammasome Signaling and Cell Death: S. Feng, et al.; J. Mol. Biol. 430, 3068 (2018)
- Inflammasome-activated gasdermin D causes pyroptosis by forming membrane pores: X. Liu, et al.; Nature 535, 153 (2016)
- Gasdermin D Restrains Type I Interferon Response to Cytosolic DNA by Disrupting Ionic Homeostasis: I. Banerjee, et al.; Immunity 49, 413 (2018)
- The Pore-Forming Protein Gasdermin D Regulates Interleukin-1 Secretion from Living Macrophages: C.L. Evavold, et al.; Immunity 48, 35 (2018)
- Noncanonical inflammasome signaling elicits gasdermin D-dependent neutrophil extracellular traps: K.W. Chen, et al.; Sci. Immunol. 3, 26 (2018)
- Lipid Peroxidation Drives Gasdermin D-mediated Pyroptosis in Lethal Polymicrobial Sepsis: R. Kang, et al.; Cell Host Microbe 24, 97 (2018)
- Chemical disruption of the pyroptotic pore-forming protein gasdermin D inhibits inflammatory cell death and sepsis: J.K. Rathkey, et al.; Sci. Immunol. 3, 26 (2018)
- Pathogen blockade of TAK1 triggers caspase-8-dependent cleavage of gasdermin D and cell death: P. Orning, et al.; Science (Epub ahead of print) 26 (2018)