Die Bedeutung der Begriffe "Enzymeinheiten", "Enzymaktivität" und "spezifische Enzymaktivität" führen oft zu großer Verwirrung. In unserem Leitfaden werden diese Schlüsselbegriffe in einfachen Worten erklärt und die Entwicklung von Enzymtests sowie die Bedeutung der Arbeit im "linearen Bereich" diskutiert. Wir gehen auch auf Standardkurven ein und darauf, ob Sie die Konzentration oder die absolute Menge des Produkts auf der x-Achse auftragen sollten. Es werden einige Tipps zur Einrichtung von Assay-Kontrollen und zur Subtraktion von Blindwerten gegeben. Schließlich wird erklärt, wie Enzymaktivitätswerte berechnet werden, und es wird ein einfacher Überblick über kinetische Gleichungen gegeben.
Diese Themen warten auf Sie:
1) Definitionen von Enzymeinheiten
3) Was ist die spezifische Enzymaktivität?
4) Faktoren, die die Aktivität von Enzymen beeinflussen
5) Entwicklung von Assays und die Bedeutung des linearen Bereichs
7) Assay-Volumen und -Empfindlichkeit
8) Kontinuierliche Assays (Messung des Produktauftritts über die Zeit)
9) Welche Substratkonzentration sollte ich verwenden?
11) Soll ich die Konzentration oder die absolute Menge auf der x-Achse auftragen?
12) Kontrollen und Subtraktion von "Blanko"-Daten
13) Berechnung der Aktivitätswerte
14) Enzymhemmung/Wirkstoffscreening
Jetzt kostenlos für den Biomol-Newsletter anmelden und keinen Blog-Artikel mehr verpassen!
Definitionen von Enzymeinheiten
Die Enzymologie wäre weniger kompliziert, wenn alle dieselbe Einheitendefinition verwenden würden. Eine Standarddefinition für Enzymeinheiten, die sogenannten „Units“, ist unten angegeben:
1 Unit (U) ist die Menge an Enzym, die die Reaktion von 1 µmol Substrat pro Minute katalysiert (Definition A).
In den meisten F&E-Bereichen ist 1 µmol Substrat eine ziemlich große Menge an Material. Daher werden manchmal andere Definitionen bevorzugt, um zu vermeiden, dass Mengen in Bruchteilen von Einheiten ausgedrückt werden. Die folgende Nicht-Standard-Definition wird üblicherweise verwendet:
1 Unit (U) ist die Menge an Enzym, die die Reaktion von 1 nmol Substrat pro Minute katalysiert (Definition B).
Beachten Sie, dass sich die Änderung der Definition stark auf die angegebene Anzahl der Einheiten auswirkt, d.h. 1 Enzymeinheit nach Definition A würde 1000 Einheiten nach Definition B entsprechen!
Ebenfalls zu erkennen ist, dass Enzymeinheiten als Milli-Units (oder mU) ausgedrückt werden, was ein Tausendstel einer Unit entspricht, unabhängig davon, wie die Units definiert wurden.
Natürlich ändert sich die tatsächliche Menge eines Enzyms in einem Reagenzglas nicht allein durch die Änderung der Einheitsdefinition, aber beim Vergleich der Aktivitäten von Proben verschiedener Anbieter ist Vorsicht geboten. Solange die Definitionen der Units angegeben sind, können Sie die angegebene Anzahl der Units in nmol pro Minute umrechnen. Dies ist eindeutig und ermöglicht aussagekräftige Vergleiche.
Aus Gründen der Klarheit können Sie in Ihrer eigenen Arbeit die Angabe "nmol pro min" (oder "µmol pro min") verwenden; wenn jedoch ständige Wiederholungen erforderlich sind, hat der viel kürzere Begriff "Unit" eindeutig seine Vorteile.
Was ist 'Enzymaktivität'?
Die Aktivität wird in Units pro ml (U/ml) angegeben, also in nmol pro min pro ml (wenn die Einheitendefinition B angenommen wurde). Somit unterliegen auch in Units ausgedrückte Aktivitätswerte einer illusorischen 1000-fachen "Erhöhung", wenn man von der Einheitendefinition A zur Einheitendefinition B wechselt. Auch hier können Verwirrungen vermieden werden, indem die Aktivität in nmol pro min pro ml anstatt in Units pro ml angegeben wird.
Da sich die Aktivität auf die Konzentration bezieht, folgt daraus, dass zwei Fläschchen mit Enzymen die gleiche Anzahl von Units (insgesamt) enthalten können, aber unterschiedliche Aktivitäten (Konzentrationen) aufweisen.
Was ist die spezifische Enzymaktivität?
Die spezifische Enzymaktivität (gewöhnlich einfach als "spezifische Aktivität" bezeichnet) ist die Anzahl der Enzymeinheiten pro ml geteilt durch die Proteinkonzentration in mg/ml. Spezifische Aktivitätswerte werden daher als Units/mg oder nmol/min/mg (bei Anwendung der Einheitendefinition B) angegeben.
Die spezifische Aktivität ist ein wichtiges Maß für die Reinheit eines Enzyms. Werte für verschiedene Chargen eines reinen Enzyms sollten im Rahmen des normalen experimentellen Fehlers gleich sein.
Serielle Verdünnungen einer Enzymlösung haben unterschiedliche Werte für die Enzymaktivität, aber identische Werte für die spezifische Aktivität, da bei der Berechnung der spezifischen Aktivität der Zähler (Einheiten/ml) und der Nenner (mg/ml) gleichermaßen von der Probenverdünnung beeinflusst werden.
Obwohl sich die spezifische Aktivität stark von der Aktivität unterscheidet, hängt die Berechnung der spezifischen Aktivität dennoch vom Aktivitätswert ab. Daher ist der angegebene spezifische Aktivitätswert auch von der Definition der Enzymeinheit abhängig. Chargen, die unter dem erwarteten spezifischen Aktivitätswert liegen, können Verunreinigungen oder denaturierte Enzymmoleküle enthalten.
Faktoren, die die Aktivität von Enzymen beeinflussen
In diesem Abschnitt wird diskutiert, warum ein Enzym in verschiedenen Laboren unterschiedliche gemessene Aktivitätswerte aufweisen kann. Damit sind tatsächliche Unterschiede in der gemessenen Aktivität gemeint, nicht scheinbare Unterschiede, die durch die Verwendung verschiedener Einheitsdefinitionen verursacht werden.
Die Bedingungen, unter denen ein Assay durchgeführt wird, beeinflussen die angegebenen Aktivitätswerte. So werden beispielsweise Assays in der Regel bei einer Temperatur zwischen 20 und 37°C durchgeführt. Im Allgemeinen wird ein Enzym bei 37°C aktiver sein als bei 20°C.
Die Definition der Enzymeinheit lässt sich besser wie folgt ausdrücken:
1 Unit (U) ist die Menge an Enzym, die unter Standardbedingungen die Reaktion von 1 nmol Substrat pro Minute katalysiert.
Leider ist der Begriff "Standardbedingungen" interpretationsfähig, und zumindest in F&E-Bereichen kann es unterschiedliche Benutzerpräferenzen geben. So kann es vorkommen, dass zehn verschiedene Forschungslabore (völlig zu Recht) unterschiedliche Aktivitäten für dieselbe Enzymlösung berechnen. Die meisten Forschungslabore legen ihre eigenen "Standardbedingungen" fest und überprüfen jede neue Charge intern. Im klinischen Bereich sind die "Standardbedingungen" ausdrücklich festgelegt und alle Labore müssen identische Assays durchführen.
Entwicklung von Assays und die Bedeutung des linearen Bereichs
Der Aktivitätswert (Units/ml) für Ihr Enzym ist der wichtigste Parameter bei der Entwicklung eines Assays. Denn das Volumen (d.h. die Anzahl der Units), das Sie hinzufügen, bestimmt die Menge des Substrats, die in ein Produkt umgewandelt wird. Zur Erinnerung: 1 Unit katalysiert die Umwandlung von 1 nmol Substrat pro Minute (Definition B).
Die angegebenen Units/ml können Ihnen eine ungefähre Vorstellung davon vermitteln, wie viel Enzym Sie zugeben müssen. Da der Aktivitätswert jedoch möglicherweise nicht in einem identischen Assay wie dem Ihren ermittelt wurde, ist es üblich, serielle Verdünnungen des Enzyms herzustellen (z.B. zunächst log-Verdünnungen) und ein festes Volumen jeder Verdünnung zu testen. Je nach dem Signal des Assays (das mit der Menge des umgesetzten Substrats zusammenhängt) kann ein zweiter Versuch erforderlich sein, um eine geeignete Verdünnung zu finden.
Was genau ist die "beste" Verdünnung? Um diese Frage zu beantworten, müssen wir uns mit dem wichtigsten Aspekt des Assay-Designs befassen - dem linearen Bereich. Für die quantitative Arbeit ist es wichtig, in einem Bereich zu arbeiten, in dem die Darstellung des Assaysignals (häufig die Absorption) gegenüber der Enzymkonzentration linear ist. Die meisten Assays sind linear, wenn der Grad der Substratumsetzung weniger als 15 % beträgt – vorausgesetzt, es gibt keine anderen begrenzenden Faktoren. Durch Festlegen der Assayzeit (z.B. 30 Minuten) und der Temperatur (z.B. 25°C) kann der Grad der Umsetzung durch einfache Anpassung eines Parameters, nämlich der Anzahl der zugegebenen Enzymeinheiten, gesteuert werden.
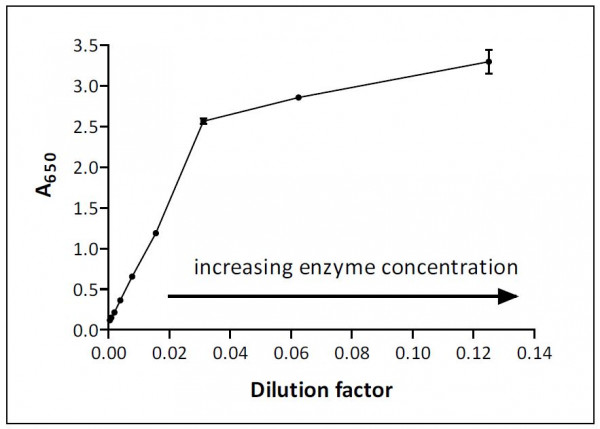
Dies ist in Abbildung 1 grafisch dargestellt, wobei die Verdünnungen als Kehrwerte ausgedrückt sind (d.h. Verdünnung von 1/10 = 0,1 auf der x-Achse). Ihr eigenes Diagramm kann in Form und linearem Bereich abweichen, jedoch wird das Assaysignal bei sehr hohen Enzymkonzentrationen sicherlich nicht proportional zur zugegebenen Enzymmenge ansteigen.
Der Assay in Abbildung 1 ist bis zu einer optischen Dichte (OD) von 2,5 linear und ein Verdünnungsfaktor von 0,02 (1/50 Verdünnung des Enzyms) wäre für die Assayarbeit ideal, da er ein starkes Signal (~1,5) ergibt und in der Mitte des linearen Bereichs liegt. Berechnungen auf der Grundlage von Ergebnissen für Verdünnungsfaktoren im Bereich zwischen 0,04 und 0,12 (d.h. der Bereich mit geringerer Steigung) werden das tatsächliche Niveau der Enzymaktivität unterschätzen, da die Stärke des Assaysignals eindeutig begrenzt ist.
Viele Faktoren können den linearen Bereich begrenzen und der Bereich variiert von Assay zu Assay. Ein häufiger Grund für die Nichtlinearität ist ein übermäßiger Substratverbrauch, der zu einem Absinken der Reaktionsgeschwindigkeit führen kann, aber auch Einschränkungen der optischen Komponenten des Plattenlesegeräts (oder des verwendeten Messgeräts) können eine Rolle spielen. Die meisten Plattenlesegeräte können beispielsweise Absorptionswerte über 3 nicht zuverlässig messen, und diese Einschränkung gilt unabhängig vom Prozentsatz des Substrats, der in Produkt umgewandelt wurde.

Abb. 1: Absorption gegen Menge des Enzyms
Auch wenn in diesem Leitfaden nicht näher darauf eingegangen wird, sollte man sich darüber im Klaren sein, dass Enzyme im Laufe der Zeit denaturieren können (insbesondere wenn sie sehr verdünnt sind) und dass die Produkte einiger Reaktionen das Enzym hemmen können. In der Tat gibt es noch andere mögliche Gründe für nicht-lineares Verhalten, aber es ist normalerweise relativ einfach, den linearen Bereich durch Ausprobieren zu finden, indem man serielle Verdünnungen des Enzyms wie oben beschrieben verwendet.
Assay-Zeit und -Temperatur
Diese Parameter können ebenfalls den linearen Bereich beeinflussen, da sie sich auf die Geschwindigkeit der Substratumwandlung auswirken. Ein Assay kann zum Beispiel nach 15 Minuten linear sein, aber nach 60 Minuten kann zu viel Substrat verbraucht worden sein. In diesem Fall müssten Sie die Enzymmenge reduzieren, um den Assay 60 Minuten lang durchführen zu können. Die gleichen Überlegungen gelten für die Assay-Temperatur, da sie ebenfalls die Reaktionsgeschwindigkeit beeinflussen kann.
Die meisten Leute nehmen eine Assay-Zeit zwischen 15 und 60 Minuten an. Sehr kurze Zeiten (z.B. 2 min) sind zu vermeiden, da eine geringfügige Verzögerung beim Stoppen der Reaktion zu einem erheblichen Fehler bei der Berechnung der Aktivität führt. Es ist wichtig, dass die im Kühlschrank oder Gefrierschrank gelagerten Reagenzien vor der Verwendung auf die richtige Temperatur gebracht werden. Dies ist besonders wichtig, wenn die Assay-Zeit relativ kurz ist.
Assay-Volumen und -Empfindlichkeit
Aus praktischer Sicht wird das Assay-Volumen durch das Verbrauchsmaterial bestimmt/begrenzt, das Sie für Ihre Assays verwenden (z.B. Küvetten, Röhrchen oder Mikrotiterplatten). Das Signal der meisten Enzymassays ist proportional zum Assay-Volumen und Versuche, den Assay zu verkleinern (z.B. um Reagenzien zu sparen), führen in der Regel zu geringeren Signalen. Absorptionsassays bilden jedoch häufig eine Ausnahme und ein Wechsel von einer 3 ml-Küvette zu einer 1 ml-Mikroküvette ändert den Absorptionsmesswert nicht, wenn die Breite (Weglänge) der Küvette immer noch 1 cm beträgt (d.h. das Licht geht immer noch durch die gleiche "Länge" der Flüssigkeit). Der Grund dafür ist, dass die Absorption proportional zur Weglänge und nicht zum Volumen der Probe ist.
Bei Absorptionsassays in Mikroplatten ist die Weglänge gleich der Tiefe der Flüssigkeit und es ist möglich, die Platten ohne Signalverlust zu verkleinern, indem der Durchmesser der Vertiefungen verringert und eine konstante Flüssigkeitstiefe beibehalten wird. Zum Beispiel können 96-Well-Platten problemlos 200 µl Probe aufnehmen, aber bei einem Assay-Volumen von 50 µl wäre es besser, eine 384-Well-Platte zu verwenden, um die Schichtdicke gegenüber 50 µl Probe in einer 96-Well-Platte zu erhöhen.
Kontinuierliche Assays (Messung des Produktauftritts über die Zeit)
Die meisten Assays werden über einen bestimmten Zeitraum durchgeführt (Endpunkt-Assays) und die Reaktion wird durch Zugabe eines Stoppreagenzes (z.B. Säure) gestoppt. Bei kontinuierlichen Assays wird jedoch das Auftreten von Produkten (seltener der Verbrauch von Substrat) fortlaufend aufgezeichnet (z.B. mit einem Diagrammschreiber). Es gelten dieselben Grundregeln: Eine Kurve des Signals über der Zeit für eine feste Enzymmenge sollte linear sein und die Rate sollte sich verdoppeln, wenn die Enzymmenge verdoppelt wird. Solange der Assay im linearen Bereich verläuft, kann die Aktivität entsprechend verdünnter "Unbekannter" anhand der anfänglichen Reaktionsgeschwindigkeiten, die mit einer Reihe von Standards gemessen wurden, genau bestimmt werden.
Welche Substratkonzentration sollte ich verwenden?
Die Konzentration des Substrats beeinflusst die Reaktionsgeschwindigkeit, aber bei der Auswahl der "richtigen" Konzentration sind mehrere Faktoren zu berücksichtigen. Aus praktischer Sicht ist eine der wichtigsten Überlegungen die Menge des Produkts, die gebildet werden muss, um ein messbares Assaysignal zu erzeugen. Da die Geschwindigkeit einer Enzymreaktion wahrscheinlich abnimmt, wenn mehr als 15 % des Substrats hydrolysiert wurden, sollte die Anfangskonzentration des Substrats im Allgemeinen mindestens das 10-fache der Produktkonzentration betragen, die für ein ausreichendes Assaysignal bekannt ist.
Eine weitere Überlegung ist der Km-Wert des Substrats. Die Zugabe von mehr Substrat führt in der Regel zu höheren Aktivitätswerten. Jedoch ist die Beziehung nicht linear und die Kosten für das Substrat müssen möglicherweise berücksichtigt werden. An dieser Stelle ist es wahrscheinlich sinnvoll, die klassische Michaelis-Menten-Gleichung einzuführen:
v = (vmax S)/(Km + S) ................ Gleichung (1)
wobei v die Geschwindigkeit, vmax die maximal mögliche Geschwindigkeit, S die Substratkonzentration und Km die Substratkonzentration ist, die die halbe maximale Aktivität ergibt. Die Herleitung dieser Gleichung und die ihr zugrundeliegenden Annahmen können in jedem Lehrbuch über Enzymkinetik nachgelesen werden. Obwohl es üblich ist, die Geschwindigkeit von Enzymreaktionen zu messen und nicht zu berechnen, ist es nützlich, die zugrundeliegenden Prinzipien zu verstehen, um einen Assay zu entwickeln.
Die Michaelis-Menten-Gleichung ist insofern nützlich, als sie Ihnen hilft, eine geeignete Substratkonzentration zu wählen, wenn der Km-Wert bekannt ist.
Wenn S=Km, v = (vmax S)/2S, d.h. v/vmax = S/2S = ½.
Mit anderen Worten: Das Enzym arbeitet mit 50 % seiner maximal möglichen Geschwindigkeit, wenn S=Km ist. Setzt man in Gleichung (1) die Werte für S = 10 und Km = 1 ein, so sieht man, dass das Enzym bei einer 10-fachen Erhöhung der Substratkonzentration nun mit ~90% seiner maximal möglichen Rate arbeitet, anstatt mit 50%. Das ist natürlich höher, aber nicht 10-mal höher. Bei sehr hohen Substratkonzentrationen wird Km in Gleichung (1) numerisch unbedeutend und die gemessene Rate entspricht dann vmax.
Viele Assays werden mit einer Substratkonzentration bei oder um den Km-Wert herum durchgeführt, aber wenn der Km-Wert sehr hoch ist, ist es unter Umständen nicht möglich, eine so hohe Substratkonzentration zu verwenden (z.B. aus Kostengründen oder wegen begrenzter Löslichkeit). In manchen Situationen kann es sogar ratsam sein, eine relativ niedrige Konzentration des Substrats zu verwenden. Bei der Entdeckung pharmazeutischer Wirkstoffe beispielsweise würde die Verwendung einer sehr hohen Substratkonzentration die Identifizierung kompetitiver Enzyminhibitoren erschweren (kompetitive Inhibitoren binden an dieselbe Stelle wie das Substrat). Es muss ein Gleichgewicht zwischen den verschiedenen Faktoren gefunden werden, damit der Assay ein messbares Signal liefert, im linearen Bereich betrieben werden kann und alle anderen Assay-Ziele (z.B. Kosten, Zeit usw.) erfüllen kann.
Standardkurven
Eine Standardkurve ist immer erforderlich, wenn Sie die Enzymaktivität berechnen wollen. Sie ist nicht unbedingt erforderlich, wenn Sie nur an den relativen Aktivitätswerten interessiert sind. Die Standardkurve wird durch Messung des Assaysignals mit Standardlösungen des Reaktionsprodukts über einen geeigneten Konzentrationsbereich erstellt. Im Idealfall sollten Sie bei jedem Experiment eine Standardkurve ermitteln, aber wenn die Standardkurve sehr gut reproduzierbar ist, kann es auch ausreichen, sie in größeren Abständen zu erstellen.
Eine typische Standardkurve ist in Abbildung 2 unten dargestellt. Es handelt sich um eine Standardkurve für einen ATPase-Assay, bei dem ATP zu ADP und Pi (anorganisches Phosphat) hydrolysiert wird.

Abb. 2: Standardkurve für Pi
Der Nachweis von Phosphat erfolgt mit Hilfe eines farbstoffbindenden Reagenzes, das bei Anwesenheit von Phosphat seine Farbe ändert. Unabhängig von der Art des Produkts oder der verwendeten Nachweismethode muss eine Standardkurve erstellt werden, die die Abhängigkeit des Signals von der Produktmenge im Assay zeigt. Die "Kurve" (im Idealfall ist es eine gerade Linie) wird verwendet, um die Produktmenge zu bestimmen, die in Proben mit unbekannter Aktivität erzeugt wird. Die Menge wird also aus dem Absorptionswert ermittelt, indem der Schnittpunkt auf der x-Achse abgelesen wird (die meisten grafischen Softwarepakete berechnen automatisch die Werte von x aus den gemessenen Werten von y). Die Aktivitätsmenge kann dann berechnet werden (siehe später).
Soll ich die Konzentration oder die absolute Menge auf der x-Achse auftragen?
Hier gibt es keine einzig richtige Antwort, und die Möglichkeit, einen der beiden Ansätze zu verwenden, kann bei der Berechnung von Aktivitätswerten oft zu Verwirrung führen. Die Darstellung von nmol des Produkts auf der x-Achse ist beispielsweise sehr praktisch, wenn Sie Aktivitätswerte berechnen müssen (zur Erinnerung: Aktivität = nmol pro min pro ml). Laborreagenzien werden jedoch in der Regel in bekannten Konzentrationen hergestellt, und es ist oft einfacher, diese Werte auf der x-Achse aufzuzeichnen. Wenn Sie jedoch die Aktivität (oder spezifische Aktivität) Ihres Enzyms berechnen, müssen Sie daran denken, die Konzentration auf der x-Achse in die Anzahl der nmol des gebildeten Produkts umzurechnen, was bedeutet, dass Sie das Assayvolumen berücksichtigen müssen. Der Grund dafür ist leicht zu verstehen: 50 µl und 100 µl einer Standardlösung haben die gleiche Konzentration, aber das größere Volumen enthält die doppelte Menge an Produkt. Im Allgemeinen ist es am besten, sich für einen Ansatz zu entscheiden (d.h. entweder die absolute Produktmenge oder die Konzentration darzustellen), damit immer die gleiche Methode zur Berechnung der Aktivität verwendet wird.
Kontrollen und Subtraktion von "Blanko"-Daten
Richtige Kontrollen sind für die quantitative Arbeit von entscheidender Bedeutung, ebenso wie die korrekte Verwendung der Kontrolldaten in den Berechnungen. Die Kontrollen geben (indirekt) Aufschluss darüber, welcher Anteil des Assaysignals auf die Wirkung des Enzyms zurückzuführen ist und welcher aus anderen Gründen entsteht. Eine häufige Quelle "falscher" Signale ist das Substrat (das oft mit dem Produkt verunreinigt sein kann). Auch andere Assay-Komponenten können je nach Art der Komponenten und der Art des Assays ein geringes Signal hervorrufen. Der Zweck der Kontrollen besteht darin, alle Elemente des Gesamtsignals zu entfernen (durch Subtraktion), die nicht mit der Wirkung des Enzyms zusammenhängen. Wenn der Assay gut konzipiert ist und die Assayreagenzien von guter Qualität sind, ist die Behandlung der Kontrollen in der Regel recht einfach.
Im Folgenden werden einige allgemeine Richtlinien gegeben:
Wenn wir auf den kolorimetrischen Assay zum Nachweis von anorganischem Phosphat (Pi) zurückkommen, können wir einige potenzielle Probleme aufzeigen, die mit geeigneten Kontrollen leicht zu erkennen sind. Das Phosphatnachweisreagenz ergibt in einer 96-Well-Platte bei der für die Messung verwendeten Wellenlänge (etwa 650 nm) einen niedrigen Wert von etwa 0,08. Wir könnten die folgenden Assays/Kontrollen einrichten (Werte in Klammern in einer hypothetischen Assay-Situation):
- Alle Assay-Komponenten minus Enzym (0,5)
- Enzym alleine (0,1)
- Enzym plus alle anderen Komponenten (1,8)
Es ist klar, dass das Assay-Signal von 1,8 nicht allein auf die Wirkung des Enzyms auf das Substrat zurückzuführen ist. Bei jedem Enzymassay besteht eine wichtige Kontrolle (A) darin, das Enzym wegzulassen (und durch Puffer zu ersetzen). Auf diese Weise erhalten Sie das Hintergrundsignal für alle anderen Assaykomponenten als Gruppe, einschließlich des Substrats, das eine geringe Menge an Produkt enthalten kann. Diese Kontrolle gibt keinen Aufschluss über das Hintergrundsignal für das Enzym, aber Sie können das Enzym natürlich nicht als Kontrolle zum Substrat hinzufügen! Bei den meisten Assays liefert das Enzym kein Signal, weil es vor der Verwendung im Assay stark verdünnt wird. Dies kann leicht überprüft werden, wie in B oben.
Die Daten für Probe A deuten darauf hin, dass die Mischung mit anorganischem Phosphat verunreinigt ist. Die einzelnen Komponenten können dann überprüft werden, um die Ursache des Problems zu ermitteln. Diese Situation ist bei Assays von ATPasen und anderen phosphaterzeugenden Enzymen recht häufig, da die Substrate oft instabil sind und teilweise hydrolysiert werden, so dass etwas anorganisches Phosphat entsteht.
Es kann schwierig sein, Rohdaten zu korrigieren, wenn mehrere Komponenten falsche Signale liefern; die Beseitigung des Problems an der Quelle ist im Allgemeinen viel besser als jede mathematische Behandlung. Der "korrigierte" Wert für die obige Probe C scheint 1,2 zu sein (d. h. 1,8 - 0,5 - 0,1), aber streng genommen ist dies falsch. Denken Sie daran, dass die Assayplatte und das Nachweisreagenz ein Hintergrundsignal von etwa 0,08 ergeben, so dass der größte Teil des Signals für Kontrolle A vom Kunststoff der Platte und/oder dem Nachweisreagenz herrührt. Das gleiche kleine Signal muss auch in dem Wert für die Enzymkontrolle versteckt sein. Daher haben wir bei der oben vorgenommenen Korrektur diesen versteckten Blindwert zweimal abgezogen.
Es ist immer notwendig, die Kontrollen von den Assay-Daten abzuziehen, und es ist besser, alle Substanzen (außer dem Enzym) zu kombinieren und einen einzigen Wert abzuziehen. Bei diesem Ansatz wird die Standardkurve auf die gleiche Weise behandelt und ein Kontrollwert abgezogen (d.h. der Wert, der in Abwesenheit des Produkts ermittelt wird, also analog zum oben beschriebenen Platten-/Reagenzblindwert). Somit enthalten weder die subtrahierten Assay-Daten noch die subtrahierte Standardkurve das potenziell irreführende Hintergrundsignal, das durch die Platte/das Assay-Reagenz verursacht wird.
Wie wir gesehen haben, lassen sich falsche Signale mit geeigneten Kontrollen leicht erkennen. Die beste Strategie, um Daten von guter Qualität zu erhalten, ist jedoch die Verwendung von Reagenzien mit geringem Hintergrund, so dass die Kontrollwerte niedrig sind. Es ist auch sinnvoll, ein Assaysignal (aufgrund des Enzyms) zu erzeugen, das weit über dem Hintergrundsignal liegt. Im Idealfall sollte das Signal-zu-Hintergrund-Verhältnis mindestens 5 und vorzugsweise 10 oder mehr betragen, um eine genaue quantitative Arbeit zu ermöglichen.
Berechnung der Aktivitätswerte
Diese ist recht einfach zu verstehen, wenn man von den Rohdaten des Assays schrittweise zurückrechnet. Nehmen wir zum Beispiel an, dass wir in unserer Enzymreaktion 10 nmol Produkt erzeugt haben (d.h. aus der Standardkurve des Signals gegenüber der absoluten Menge des Produkts bestimmt). Da die Aktivität als nmol pro Minute und ml ausgedrückt wird, müssen wir zur Berechnung der Aktivität die Zeit und das Volumen und, vielleicht weniger offensichtlich, die Menge und Verdünnung des Enzyms berücksichtigen.
Wenn der Assay 10 Minuten dauert, beträgt die Anzahl der nmol pro Minute im obigen Beispiel 1. (Schritt 1)
Wenn das Assayvolumen 200 µl beträgt, müssen wir mit 5 multiplizieren (d.h. 1000/200), um nmol pro min pro ml zu erhalten. (Schritt 2)
Dieser Wert bezieht sich auf die Aktivität des Enzyms im Assay, nicht auf die Enzymprobe, die für die Durchführung des Assays verwendet wurde. Um die Enzymaktivität in der ursprünglichen Enzymprobe zu bestimmen, sind einige weitere Korrekturfaktoren erforderlich.
Das Enzym kann vor der Verwendung verdünnt worden sein, und es muss durch die anderen im Assay vorhandenen Komponenten weiter verdünnt werden. Wenn der Assay (insgesamt 200 µl) 20 µl Enzym enthält und das Enzym vor der Zugabe der 20 µl-Probe um 1/100 vorverdünnt wird, können Sie wahrscheinlich erkennen, dass wir zuerst mit 10 (Schritt 3) und dann mit 100 (Schritt 4) multiplizieren sollten, um die Aktivität des Enzyms in der ursprünglichen Enzymlösung zu erhalten.
So weit ist das relativ einfach. Wir haben jedoch bereits erwähnt, dass die Konzentration häufig auf der x-Achse der Standardkurve aufgetragen wird. Daher kann es sein, dass die Werte in mM (und nicht in mmol) ausgedrückt werden und Sie können die Anzahl der mmol nicht einfach durch die Untersuchung der Standardkurve bestimmen.
Da mM gleichbedeutend mit mmol pro Liter ist, besteht eine Diskrepanz zwischen dem implizierten Volumen von 1 l und dem tatsächlichen Assay-Volumen. Wenn wir also 10 mM Produkt haben und das Assay-Volumen 200 l beträgt, müssen wir durch 5000 dividieren, um die Anzahl der mmol des Produkts zu erhalten.
Sie werden feststellen, dass die Division durch 5000 hier einige der oben erforderlichen Multiplikationsoperationen ausgleicht. In der Tat ist es ganz normal, dass sich Korrekturfaktoren aufheben. Bei einem 10-Minuten-Assay mit 1/10 verdünntem Enzym dividiert man beispielsweise durch 10, um nmol pro Minute zu erhalten, und multipliziert später mit 10, um den Verdünnungsfaktor zu korrigieren.
Daraus folgt, dass Sie, wenn Sie immer Standardtestbedingungen (d.h. Ihren Standard) verwenden, den "x"-Wert der Standardkurve mit einem einzigen globalen Korrekturfaktor multiplizieren können, der alle anderen individuellen Korrekturfaktoren umfasst, um Ihre Aktivitätswerte zu berechnen. Nur beim ersten Mal müssen Sie die einzelnen Korrekturfaktoren ermitteln.
Enzymhemmung/Wirkstoffscreening
Dies ist ein Bereich der Enzymologie, in dem die Notwendigkeit besteht, im linearen Bereich zu arbeiten, in dem aber Berechnungen von Aktivitätswerten in der Regel nicht relevant sind. Vielmehr ist die relative Reaktionsgeschwindigkeit (oder die relative Menge des gebildeten Produkts) in Anwesenheit und Abwesenheit einer Prüfsubstanz entscheidend, was wenig mehr als einfache Berechnungen unter Verwendung der Blindwert-Subtraktionsdaten erfordert. Nach Abzug der Blindproben wird die Menge des gebildeten Produkts als Prozentsatz der in Abwesenheit der Prüfsubstanz erhaltenen Menge (d.h. 100%) ausgedrückt. Diese Assays können manchmal mit recht niedrigen Signal-zu-Hintergrund-Verhältnissen durchgeführt werden, da die Frage, die gestellt wird ("Hemmt die Assay-Substanz die Reaktion?") nur eine Ja/Nein-Antwort erfordert.
Zusammenfassung
Dieser Leitfaden konnte hoffentlich klare Erklärungen zu den Begriffen "Enzymeinheiten", "Enzymaktivität" und "spezifische Enzymaktivität" sowie zu den Definitionen von Units und der Bedeutung des "linearen Bereichs" liefern. Was genau auf der x-Achse von Standardkurven aufgetragen werden soll, ist eine Frage der Präferenz des Anwenders, aber bei der Berechnung von Aktivitäten ist eine gewisse Vorsicht angebracht. Assay-Kontrollen sind wichtig, aber die Verwendung hochwertiger Reagenzien ist besser als die Entfernung des Hintergrunds durch mathematische Ansätze. Ein hohes Signal-Hintergrund-Verhältnis ist für quantitative Arbeiten wünschenswert, und eine Reihe von Parametern kann variiert werden, um das Assay-Signal zu erhöhen; es ist nicht immer notwendig, einfach mehr Enzym hinzuzufügen. Die Werte für die Enzymaktivität lassen sich leicht berechnen, wenn ein schrittweiser Ansatz zur Ermittlung der wichtigsten Assay-Variablen verwendet wird.