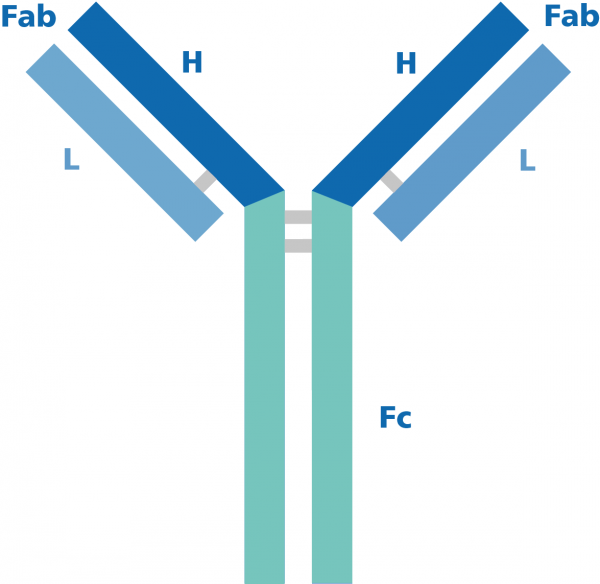
Assays auf Antikörperbasis bzw. Immunoassays sind oft genutzte und wichtige Werkzeuge in den Gebieten der Grundlagenforschung, Bioverfahrenstechnik, Diagnostik und Klinik. Auch wenn die erfolgreiche Detektion des Zielproteins von diversen Parametern abhängt, so ist es doch hinreichend anerkannt, dass die Verwendung hochqualitativer Antikörper die Leistungsfähigkeit und Verlässlichkeit eines Assays maßgeblich verbessert. Bei Immunassays werden sehr häufig Sekundärantikörper verwendet, die den Primärantikörper binden und so zur Detektion und Aufreinigung der Zielantigene beitragen. Insofern sind für erfolgreiche und aussagekräftige Immunassays nicht nur hochspezifische und sensitive Primärantikörper vonnöten sondern auch hochqualitative Sekundärantikörper. Die folgende Roadmap führt Sie Schritt für Schritt durch den Auswahlprozess der besten Sekundärantikörper für Ihre Experimente:
1. Beachten Sie die Wirtsspezies des Primärantikörpers
Zunächst müssen Sie herausfinden, welche Wirtsspezies für die Herstellung Ihres Primärantikörpers verwendet wurde. Dann wählen Sie einen Sekundärantikörper passend zu der Wirtsspezies des jeweiligen Primärantikörpers. Wenn Sie beispielsweise einen im Kaninchen (Rabbit) produzierten Primärantikörper benutzen, müssen Sie einen anti-rabbit Sekundärantikörper wählen, der in einer anderen Wirtspezies, wie zum Beispiel Maus, Ziege oder Esel, gebildet wurde. Aus diesem Grund werden in der Regel polyklonale anti-Maus, anti-Kaninchen, anti-Ziege oder anti-Huhn Sekundärantikörper bei der Detektion von Antigenen verwendet. Merke: Die Spezies, die den Sekundärantikörper generiert hat, sollte sich stets von der Wirtsspezies des Primärantikörpers unterscheiden.
2. Auswahl des korrekten Reporters für die geplante Anwendung
 Für die Auswahl des optimalen Sekundärantikörpers müssen Sie neben der Wirtsspezies auch die exakten Anforderungen der Methode, die Sie verwenden möchten, bedenken. Für alteingesessene Standardverfahren wie Western blot und ELISA ist ein mit einem Enzym konjugierter Antikörper aller Wahrscheinlichkeit nach die beste Wahl. Häufig hierbei verwendete Enzyme sind Peroxidasen und Alkalische Phosphatasen. Bei anderen Immunoassays wie Immunfluoreszenz-Mikroskopie oder Durchflusszytometrie sind die Sekundärantikörper typischerweise mit einem Fluoreszenzfarbstoff (z.B. FITC, DyLight™ oder Cy™) konjugiert. Bei der Methode der Immunpräzipitation benötigen Sie für publikationstaugliche Abbildungen spezielle Reagenzien, die unspezifisch präzipitierten Antikörper nicht detektieren. Rocklands TrueBlot®-Produkte helfen Ihnen diese Signale zu verhindern, in dem sie nur die native Disulfidform des Immunglobulins G binden.
Für die Auswahl des optimalen Sekundärantikörpers müssen Sie neben der Wirtsspezies auch die exakten Anforderungen der Methode, die Sie verwenden möchten, bedenken. Für alteingesessene Standardverfahren wie Western blot und ELISA ist ein mit einem Enzym konjugierter Antikörper aller Wahrscheinlichkeit nach die beste Wahl. Häufig hierbei verwendete Enzyme sind Peroxidasen und Alkalische Phosphatasen. Bei anderen Immunoassays wie Immunfluoreszenz-Mikroskopie oder Durchflusszytometrie sind die Sekundärantikörper typischerweise mit einem Fluoreszenzfarbstoff (z.B. FITC, DyLight™ oder Cy™) konjugiert. Bei der Methode der Immunpräzipitation benötigen Sie für publikationstaugliche Abbildungen spezielle Reagenzien, die unspezifisch präzipitierten Antikörper nicht detektieren. Rocklands TrueBlot®-Produkte helfen Ihnen diese Signale zu verhindern, in dem sie nur die native Disulfidform des Immunglobulins G binden.
3. Nutzen Sie gegebenenfalls präadsorbierte Sekundärantikörper!
Präadsorption (oder Kreuzadsorption) ist eine Methode mit der die Kreuzreaktivität von Antikörpern, d.h. die ungewünschte Bindung des Antikörpers zu bestimmten Spezies, Antikörperfragmenten oder Zell- und Gewebekomponenten eliminiert und somit die Spezifität des Antikörpers verbessert werden kann. Der Grad der Kreuzreaktivität wird zunächst mit ELISA oder Western Blot bestimmt und beträgt typischerweise etwa 1% des eigentlichen Signals. Anschließend wird der Sekundärantikörper gegen Antikörper des Serums anderer unerwünschter Spezies adsorbiert. Die verbleibenden nicht bindenden Antikörper besitzen folglich eine deutlich geringere Kreuzreaktivität und eignen sich somit besonders für Experimente, bei denen mehrere Targets angefärbt werden sollen.
4. Bedenken Sie die Klasse und den Subtyp des Primärantikörpers!
Polyklonale Primärantikörper werden in Kaninchen, Ziege, Esel oder Huhn generiert und sind üblicherweise gamma-Immunglobuline (IgG). Daher sollte der Sekundärantikörper ein anti-IgG-Antikörper sein, der sowohl leichte als auch schwere Ketten des Primärantikörpers erkennt (anti-IgG H&L). Monoklonale Primärantikörper werden normalerweise durch B-Zellhybridomen von Maus, Ratte und Grauem Zwerghamster aber auch Kaninchen oder Mensch hergestellt. Da monoklonale Antikörper anders als polyklonale alle einen spezifischen Subtyp angehören, ist es entscheidend, dass der Sekundärantikörper eben diesen Subtyp auch bindet. Es wird zwar häufig behauptet, dass jeder anti-Maus IgG-Antikörper jeden Maus IgG Subtyp erkennt, allerdings haben neuere Studien ergeben, dass Antikörper manche Subtypen den anderen vorziehen. Daher verbessert die Verwendung subtypenspezifischer Antikörper gerade bei Multiplex-Anwendungen deutlich die Zuverlässigkeit der Ergebnisse. Für einen tieferen Einblick in dieses Thema empfehlen wir das Review von Manning et al. (2012). Falls der Subtyp des Primärantikörpers nicht bekannt ist, können Sie anti-IgG F(ab)verwenden oder einen Isotypisierungsassay durchführen.
5. Manchmal ist kleiner besser
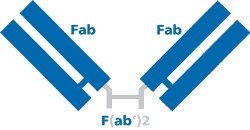 F(ab')2-Fragment Sekundärantikörper werden durch die Verdauung ganzer IgG Antikörper mit Pepsin gebildet. Hierbei wird ein Großteil der Fc-Region unterhalb der Gelenkregion abgespalten, wodurch ein divalentes Fragment mit einem Molekulargewicht von etwa 110 kDa entsteht. Fab-Antikörperfragmente entstehen bei der Verdauung mit Papain, bei der der gesamte Fc-Abschnit abgespalten wird. Die zwei resultierenden Fab-Fragmente enthalten jeweils nur eine Antigenbindungsstelle und wiegen etwa 50 kDa. Durch das Fehlen der Fc-Region können sowohl mit Fab- als auch F(ab')2-Antikörperfragmenten unspezifische Signale reduziert werden und ihrer geringeren Größe leichter in Gewebe eindringen. Bei der Arbeit mit Geweben und Zellen, die den Fc Rezeptor tragen (d.h. Milz, Blut, hämatopoetische Zellen, Leukozyten, NK Zellen etc), ist die Verwendung von Fragmentantikörpern besonders empfehlenswert. Konjugierte Fragmentantikörper eignen sich somit ideal für Anwendungen wie Durchflusszytometrie, Immunhistochemie und Immunfluoreszenz.
F(ab')2-Fragment Sekundärantikörper werden durch die Verdauung ganzer IgG Antikörper mit Pepsin gebildet. Hierbei wird ein Großteil der Fc-Region unterhalb der Gelenkregion abgespalten, wodurch ein divalentes Fragment mit einem Molekulargewicht von etwa 110 kDa entsteht. Fab-Antikörperfragmente entstehen bei der Verdauung mit Papain, bei der der gesamte Fc-Abschnit abgespalten wird. Die zwei resultierenden Fab-Fragmente enthalten jeweils nur eine Antigenbindungsstelle und wiegen etwa 50 kDa. Durch das Fehlen der Fc-Region können sowohl mit Fab- als auch F(ab')2-Antikörperfragmenten unspezifische Signale reduziert werden und ihrer geringeren Größe leichter in Gewebe eindringen. Bei der Arbeit mit Geweben und Zellen, die den Fc Rezeptor tragen (d.h. Milz, Blut, hämatopoetische Zellen, Leukozyten, NK Zellen etc), ist die Verwendung von Fragmentantikörpern besonders empfehlenswert. Konjugierte Fragmentantikörper eignen sich somit ideal für Anwendungen wie Durchflusszytometrie, Immunhistochemie und Immunfluoreszenz.
6. Nutzen Sie einen Sekundärantikörper von angemessener Reinheit
Monospezifische Antikörper werden in der Regel mittels Festphasen-Affinitätschromatographie von den anderen Proteinen des Antiserums sowie unspezifischen Immunglobulinen getrennt. Die Vorteile dieser Methode sind erhöhte Spezifität und Sensitivität sowie geringere Hintergrundsignale und Variationen zwischen den Chargen, wodurch die Reproduzierbarkeit der Ergebnisse deutlich erleichtert wird. IgG Fraktionen werden hingegen mit einer Kombination aus Salzfraktionierung und chromatographischen Methoden hergestellt. Der Hauptvorteil dieser Technik liegt in der Präsenz extrem affiner Antikörper, was in einer stärkeren Bindung des Sekundärantikörpers resultiert. Bei der Affinitätschromatographie gehen diese hochaffinen Antikörper wegen ihrer z.T. geringeren Spezifität manchmal verloren. Für den Nachweis von Proteinen und Antikörpern geringer Konzentration ist daher die Verwendung von IgG Fraktionen manchmal vorteilhaft. Assays, bei denen die Hintergrundsignale bzw. Kreuzreaktionen minimiert werden müssen, liefern durch affinitätsgereinigte Antikörper bessere Resultate.
 Camilo Moncada, Ph.D. ist ein leitender Wissenschaftler und Direktor der Qualitätskontrolle bei Rockland Immunochemicals, einem führenden Unternehmen für Antikörperentwicklung und -herstellung. Dr. Moncada begann seine wissenschaftliche Karriere vor über 10 Jahren und publizierte in den Forschungsgebieten Immunologie, Parasitologie, Krebs sowie Lungenerkrankungen bevor er sich für den Wechsel in die Industrie entschied. Bei Rockland nutzt er seine Expertise in Zell- und Molekularbiologie, Biochemie und Proteomics in der Entwicklung und Validierung neuer Antikörper.
Camilo Moncada, Ph.D. ist ein leitender Wissenschaftler und Direktor der Qualitätskontrolle bei Rockland Immunochemicals, einem führenden Unternehmen für Antikörperentwicklung und -herstellung. Dr. Moncada begann seine wissenschaftliche Karriere vor über 10 Jahren und publizierte in den Forschungsgebieten Immunologie, Parasitologie, Krebs sowie Lungenerkrankungen bevor er sich für den Wechsel in die Industrie entschied. Bei Rockland nutzt er seine Expertise in Zell- und Molekularbiologie, Biochemie und Proteomics in der Entwicklung und Validierung neuer Antikörper.