Cookie-Einstellungen
Diese Website benutzt Cookies, die für den technischen Betrieb der Website erforderlich sind und stets gesetzt werden. Andere Cookies, die den Komfort bei Benutzung dieser Website erhöhen, der Direktwerbung dienen oder die Interaktion mit anderen Websites und sozialen Netzwerken vereinfachen sollen, werden nur mit Ihrer Zustimmung gesetzt.
Konfiguration
Technisch erforderlich
Diese Cookies sind für die Grundfunktionen des Shops notwendig.
"Alle Cookies ablehnen" Cookie
"Alle Cookies annehmen" Cookie
Ausgewählter Shop
CSRF-Token
Cookie-Einstellungen
FACT-Finder Tracking
Individuelle Preise
Kundenspezifisches Caching
Session
Währungswechsel
Komfortfunktionen
Diese Cookies werden genutzt um das Einkaufserlebnis noch ansprechender zu gestalten, beispielsweise für die Wiedererkennung des Besuchers.
Facebook-Seite in der rechten Blog - Sidebar anzeigen
Merkzettel
Statistik & Tracking
Endgeräteerkennung
Kauf- und Surfverhalten mit Google Tag Manager
Partnerprogramm
Bei Fragen nutzen Sie gerne unser Kontaktformular.
Bestellen Sie auch per E-Mail: info@biomol.com
Größere Menge gewünscht? Bulk-Anfrage
Bestellen Sie auch per E-Mail: info@biomol.com
Größere Menge gewünscht? Bulk-Anfrage
Discover a breakthrough in membrane protein research and drug development with DIMA Biotech's... mehr
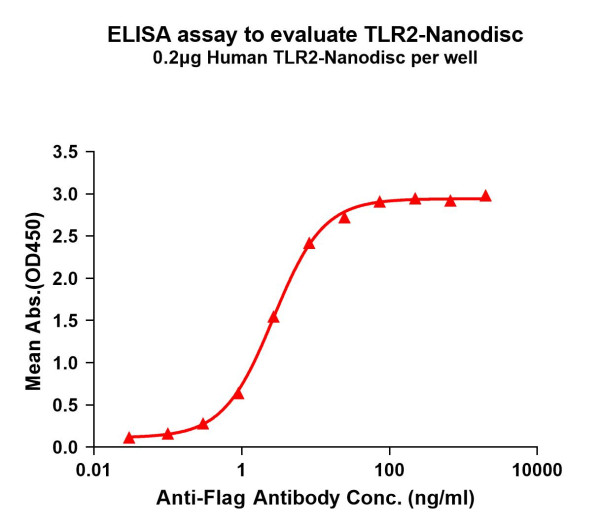
Produktinformationen "TLR2 (human) full length protein-synthetic nanodisc"
Discover a breakthrough in membrane protein research and drug development with DIMA Biotech's Synthetic Nanodiscs. Traditional methods struggle with challenges in obtaining water-soluble and bioactive forms of multi-transmembrane proteins. Our innovative polymer-based Nanodisc platform offers a game-changing solution by excluding membrane scaffold proteins (MSPs), resulting in a cleaner system with fewer interferences for downstream assays. By disassembling cell membranes into nanoscale disc-shaped structures, our technology enables the purification of membrane proteins to high homogeneity under aqueous conditions. Explore how Synthetic Nanodiscs empower the functional characterization of multi-span transmembrane proteins in their active form, revolutionizing the future of membrane protein research and drug development. Protein function: Cooperates with LY96 to mediate the innate immune response to bacterial lipoproteins and other microbial cell wall components. Cooperates with TLR1 or TLR6 to mediate the innate immune response to bacterial lipoproteins or lipopeptides (PubMed:21078852, PubMed:17889651). Acts via MYD88 and TRAF6, leading to NF-kappa-B activation, cytokine secretion and the inflammatory response. May also activate immune cells and promote apoptosis in response to the lipid moiety of lipoproteins (PubMed:10426995, PubMed:10426996). Recognizes mycoplasmal macrophage-activating lipopeptide-2kD (MALP-2), soluble tuberculosis factor (STF), phenol-soluble modulin (PSM) and B.burgdorferi outer surface protein A lipoprotein (OspA-L) cooperatively with TLR6 (PubMed:11441107). Stimulation of monocytes in vitro with M.tuberculosis PstS1 induces p38 MAPK and ERK1/2 activation primarily via this receptor, but also partially via TLR4 (PubMed:16622205). MAPK activation in response to bacterial peptidoglycan also occurs via this receptor (PubMed:16622205). Acts as a receptor for M.tuberculosis lipoproteins LprA, LprG, LpqH and PstS1, some lipoproteins are dependent on other coreceptors (TLR1, CD14 and/or CD36), the lipoproteins act as agonists to modulate antigen presenting cell functions in response to the pathogen (PubMed:19362712). M.tuberculosis HSP70 (dnaK) but not HSP65 (groEL-2) acts via this protein to stimulate NF-kappa-B expression (PubMed:15809303). Recognizes M.tuberculosis major T-antigen EsxA (ESAT-6) which inhibits downstream MYD88-dependent signaling (shown in mouse). Forms activation clusters composed of several receptors depending on the ligand, these clusters trigger signaling from the cell surface and subsequently are targeted to the Golgi in a lipid-raft dependent pathway. Forms the cluster TLR2:TLR6:CD14:CD36 in response to diacylated lipopeptides and TLR2:TLR1:CD14 in response to triacylated lipopeptides (PubMed:16880211). Required for normal uptake of M.tuberculosis, a process that is inhibited by M.tuberculosis LppM. [The UniProt Consortium]
| Schlagworte: | TLR2, TIL4, CD282, Toll-like receptor 2, Toll/interleukin-1 receptor-like protein 4, CD282, TIL4, Human TLR2 full length protein-synthetic nanodisc |
| Hersteller: | DIMA |
| Hersteller-Nr: | FLP100140 |
Eigenschaften
| Anwendung: | Full length transmembrane protein, FA, ELISA, screening, immunization, cell-based assays, crystallization |
| Konjugat: | No |
| Wirt: | Human cells |
| Spezies-Reaktivität: | human |
| MW: | 89.8 kD |
| Format: | Lyophilized |
Datenbank Information
| KEGG ID : | K10159 | Passende Produkte |
| UniProt ID : | O60603 | Passende Produkte |
| Gene ID : | GeneID 7097 | Passende Produkte |
Handhabung & Sicherheit
| Lagerung: | -20°C (avoid repeat freezing and thawing cycles) |
| Versand: | +20°C (International: +20°C) |
Achtung
Nur für Forschungszwecke und Laboruntersuchungen: Nicht für die Anwendung im oder am Menschen!
Nur für Forschungszwecke und Laboruntersuchungen: Nicht für die Anwendung im oder am Menschen!
Hier kriegen Sie ein Zertifikat
Loggen Sie sich ein oder registrieren Sie sich, um Analysenzertifikate anzufordern.
Bewertungen lesen, schreiben und diskutieren... mehr
Kundenbewertungen für "TLR2 (human) full length protein-synthetic nanodisc"
Bewertung schreiben
Loggen Sie sich ein oder registrieren Sie sich, um eine Produktbewertung abzugeben.
Zuletzt angesehen