Cookie-Einstellungen
Diese Website benutzt Cookies, die für den technischen Betrieb der Website erforderlich sind und stets gesetzt werden. Andere Cookies, die den Komfort bei Benutzung dieser Website erhöhen, der Direktwerbung dienen oder die Interaktion mit anderen Websites und sozialen Netzwerken vereinfachen sollen, werden nur mit Ihrer Zustimmung gesetzt.
Konfiguration
Technisch erforderlich
Diese Cookies sind für die Grundfunktionen des Shops notwendig.
"Alle Cookies ablehnen" Cookie
"Alle Cookies annehmen" Cookie
Ausgewählter Shop
CSRF-Token
Cookie-Einstellungen
FACT-Finder Tracking
Individuelle Preise
Kundenspezifisches Caching
Session
Währungswechsel
Komfortfunktionen
Diese Cookies werden genutzt um das Einkaufserlebnis noch ansprechender zu gestalten, beispielsweise für die Wiedererkennung des Besuchers.
Facebook-Seite in der rechten Blog - Sidebar anzeigen
Merkzettel
Statistik & Tracking
Endgeräteerkennung
Kauf- und Surfverhalten mit Google Tag Manager
Partnerprogramm
| Artikelnummer | Größe | Datenblatt | Manual | SDB | Lieferzeit | Menge | Preis |
|---|---|---|---|---|---|---|---|
| Cay13866-50 | 50 µg | - | - |
6 - 10 Werktage* |
661,00 €
|
Bei Fragen nutzen Sie gerne unser Kontaktformular.
Bestellen Sie auch per E-Mail: info@biomol.com
Größere Menge gewünscht? Bulk-Anfrage
Bestellen Sie auch per E-Mail: info@biomol.com
Größere Menge gewünscht? Bulk-Anfrage
Protein arginine methyltransferases (PRMTs) are a family of enzymes with highly conserved... mehr
Produktinformationen "PRMT6 (human recombinant, baculovirus expressed)"
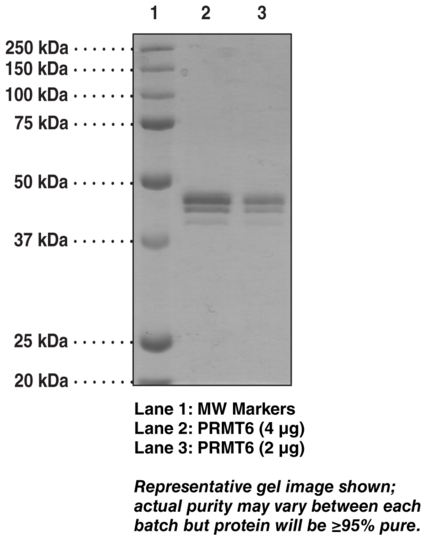
Protein arginine methyltransferases (PRMTs) are a family of enzymes with highly conserved catalytic domains that catalyze the transfer of a methyl group from S-adenosyl-L-methionine to a specific arginine residue in a target protein. PRMT6 is a nuclear type-1 PRMT, catalyzing the formation of omega-NG-monomethylarginine and asymmetric omega-NG,NG-dimethylarginine on both histone and non-histone targets. Histone H3 methylation of arginine 2 (H3R2) is a repressive transcriptional mark primarily catalyzed by PRMT6. H3R2 dimethylation antagonizes the binding of effector proteins sensitive to H3K4 methylation, such as the Mixed Lineage Leukemia complex methyltransferase. Non-histone targets of PRMT6 include the nuclear high-mobility group protein HMGA1a, a protein important in several processes relating to the maintenance of DNA integrity.Synonyms: Histone Arginine N-methyltransferase PRMT6, HRMT1L6, Protein Arginine Methyltransferase 6. Purity: >60%. Source: Recombinant N-terminal His-tagged protein expressed in Sf21 cells. Amino Acids: 2-375 (full length). MW: 43.7 kDa. Formulation: (Request formulation change), 50 mM Tris-HCl, pH 8.0, with 150 mM sodium chloride and 20% glycerol. UniProt Accession #: Q96LA8.
| Schlagworte: | PRMT6, HRMT1L6, Protein arginine N-methyltransferase 6, Protein arginine N-methyltransferase 6, Histone-arginine N-methyltransferase PRMT6, Histone-arginine N-methyltransferase PRMT6, Heterogeneous nuclear ribonucleoprotein methyltransferase-like protein |
| Hersteller: | Cayman Chemical |
| Hersteller-Nr: | 13866 |
Eigenschaften
| Anwendung: | Enzyme activity |
| Konjugat: | No |
| Wirt: | Insect cells |
| Spezies-Reaktivität: | human |
| MW: | 43,7 kD |
| Reinheit: | >60% |
Datenbank Information
| KEGG ID : | K11437 | Passende Produkte |
| UniProt ID : | Q96LA8 | Passende Produkte |
| Gene ID : | GeneID 55170 | Passende Produkte |
Handhabung & Sicherheit
| Lagerung: | -80°C |
| Versand: | -80°C (International: -80°C) |
Achtung
Nur für Forschungszwecke und Laboruntersuchungen: Nicht für die Anwendung im oder am Menschen!
Nur für Forschungszwecke und Laboruntersuchungen: Nicht für die Anwendung im oder am Menschen!
Hier folgen Informationen zur Produktreferenz.
mehr
Hier kriegen Sie ein Zertifikat
Loggen Sie sich ein oder registrieren Sie sich, um Analysenzertifikate anzufordern.
Bewertungen lesen, schreiben und diskutieren... mehr
Kundenbewertungen für "PRMT6 (human recombinant, baculovirus expressed)"
Bewertung schreiben
Loggen Sie sich ein oder registrieren Sie sich, um eine Produktbewertung abzugeben.
Zuletzt angesehen



